Le traitement du cancer du pancréas
Quels sont les différents types de traitements et comment se prend la décision thérapeutique ?
Les armes majeures du traitement des cancers utilisées contre le cancer du pancréas sont la chirurgie, la chimiothérapie et la radiothérapie.
En complément de ces traitements qui visent à réduire la tumeur, il faut ajouter les techniques d’endoscopie digestive qui permettent de poser des prothèses (ou stents) dans le tube digestif ou la voie biliaire. Dans certains cas, il est possible également de mettre des prothèses sous contrôle radiologique (« radiologie interventionnelle »).
La chimiothérapie repose sur l’administration de produits détruisant la tumeur par « cytotoxicité ».
De nouveaux médicaments dirigés contre des cibles moléculaires précises de la cellule, reconnues pour inhiber des oncogènes ou les mécanismes de cancérisation -telle la signalisation cellulaire- sont en développement pour le traitement des cancers, dont le cancer du pancréas.
Enfin, il faut signaler l’importance de la stratégie thérapeutique pour appliquer au mieux, dans un ordre précis selon le stade de la tumeur, les différents traitements et pour hiérarchiser les modes de prise en charge.
Le diagnostic et la prise en charge d’un cancer du pancréas nécessitent la participation de plusieurs praticiens :
- le médecin généraliste, souvent le premier à intervenir, qui décide de faire des examens pour rechercher la cause des symptômes du patient,
- le radiologue qui interprète les images des examens demandés (en particulier le scanner) dans le cadre du bilan initial,
- le gastro-entérologue qui réalise des examens endoscopiques appropriés (gastroscopie, écho-endoscopie) pour affirmer le diagnostic (biopsie), – le chirurgien qui peut intervenir pour enlever la tumeur ou, dans certains cas, dériver le tube digestif ou les canaux biliaires s’ils sont obstrués,
- le pathologiste (ou anciennement, anatomo-pathologiste) qui analyse les biopsies ou la pièce opératoire, et pose le diagnostic de certitude,
- le biologiste qui interprète les résultats des prises de sang réalisées sur le patient,
- l’oncologue radiothérapeute et l’oncologue médical qui administrent la radiothérapie ou les traitements généraux comme la chimiothérapie et les thérapies ciblées.
Ces spécialistes décident ensemble, lors d’une Réunion de Concertation Pluri-disciplinaire (RCP), de la meilleure stratégie de traitement à utiliser une fois le diagnostic et le bilan d’extension établis.
Cette décision tient compte aussi de l’état général du patient, de son âge, de ses antécédents de santé, etc.
La prise en charge nécessite aussi l’intervention de nombreux autres acteurs de soins : infirmiers, aides-soignants, psychologues, diététicien(ne)s, assistantes sociales, etc.
La mise en place de ces RCP est une des avancées majeures du Plan Cancer instauré en France en 2002. Ces RCP garantissent que la décision thérapeutique est collégiale (c’est-à-dire partagée par plusieurs spécialistes à la fois) et qu’elle est conforme aux référentiels (c’est-à-dire aux règles établies par des spécialistes du cancer et adoptées par la communauté médicale dans son ensemble).
Lors de la consultation d’annonce, il est recommandé au patient et à ses proches de poser toutes les questions relatives aux détails de son traitement et à sa prise en charge.
Les consultations d’annonce sont une autre avancée du Plan Cancer : elles sont maintenant effectives dans la plupart des lieux de traitement du cancer et sont un complément des consultations médicales réalisées.
1. La chirurgie
Quelle est la place de la chirurgie dans le traitement des cancers du pancréas ?
Le pancréas est un organe vital mais dont les fonctions peuvent être remplacées. En général, l’ablation d’une tumeur permet de conserver une quantité suffisante de pancréas et ainsi d’éviter la survenue d’un diabète s’il n’existait pas au préalable.
La survenue d’une mauvaise digestion des graisses -pouvant occasionner une diarrhée- doit être compensée par la prise de médicaments appelés extraits pancréatiques, à absorber au début des repas ou collations.
L’ablation de la tumeur n’est possible que si le cancer est limité au pancréas, sans métastases, ni envahissement des gros vaisseaux avoisinants. C’est le bilan d’imagerie préopératoire (notamment le scanner) qui permet de l’affirmer au mieux, sachant que le chirurgien peut modifier le geste prévu initialement en fonction de ce qu’il découvre pendant l’intervention.
Dans des cas exceptionnels, le chirurgien peut être amené à enlever la totalité du pancréas, mais un diabète survient alors systématiquement nécessitant un traitement à vie par insuline. Avant la chirurgie, le patient aura à prendre pendant 7 jours un traitement appelé immuno-nutrition par voie orale qui vise à augmenter ses défenses immunitaires pour limiter les complications après la chirurgie.
On lui proposera peut-être aussi une étape de pré-habilitation avant l’opération qui consiste à remettre le patient le plus en forme possible et à augmenter un peu sa capacité respiratoire par des exercices physiques adaptés à son état (souvent du vélo en salle). Différentes interventions chirurgicales peuvent être proposées.
Le premier temps de l’opération proprement dite consiste d’une part en l’exploration de la cavité abdominale pour rechercher des métastases qui n’auraient pas été détectées par les examens d’imagerie réalisés durant la période préopératoire et d’autre part en l’exploration de la totalité du péritoine et les rapports de la tumeur avec les vaisseaux.
Ce premier temps peut se faire après une ouverture du ventre « classique » (appelée laparotomie) ou plus limitée (coelioscopie).
La coelioscopie (appelée encore laparoscopie) permet de visualiser l’extension de la tumeur au-delà du pancréas (ganglions, foie, péritoine) ; elle permet de faire des prélèvements en cas de besoin (biopsies). Enfin, elle est décidée par l’équipe médico-chirurgicale en fonction du bilan d’imagerie réalisé ; elle n’est en effet pas toujours nécessaire.
Il arrive parfois que la tumeur ait été jugée enlevable lors du bilan préopératoire mais les constatations pendant l’opération montrent en fait que l’ablation de la tumeur est impossible. Dans ce cas, le chirurgien peut effectuer, s’il le juge utile, une dérivation préventive des canaux biliaires et/ou du tube digestif pour mettre le patient à l’abri des compressions biliaires (jaunisse) ou digestives (occlusion digestive avec vomissements) provoquées par la croissance du cancer. Une destruction des nerfs sensitifs entourant le pancréas (plexus coeliaque) avec de l’alcool pourra être réalisée pendant l’intervention pour diminuer ou prévenir les douleurs causées par la tumeur.
Le second temps de l’opération, quand le bilan montre que la tumeur est extirpable, consiste à enlever la tumeur proprement dite. Cette dernière est repérée visuellement ou par la palpation selon sa taille.
Deux interventions de résection sont couramment réalisées, et une plus rarement.
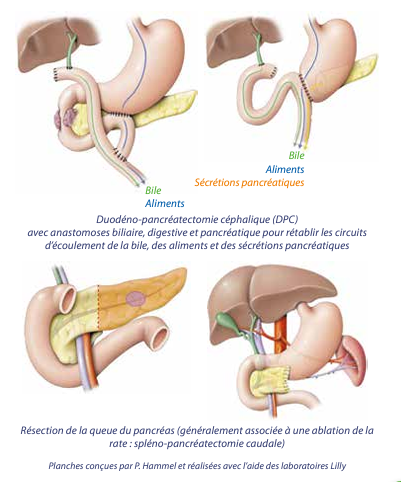
- Pour les tumeurs de la tête du pancréas, l’intervention consiste à retirer la partie droite du pancréas ; il est alors nécessaire d’enlever en même temps une partie de l’estomac et du duodénum. Cette intervention s’appelle une duodéno-pancréatectomie céphalique (DPC). Après la résection il faut reconstituer :
- le circuit digestif en suturant l’estomac restant sur l’intestin grêle : on appelle ce geste anastomose gastro-jéjunale,
- le circuit biliaire en abouchant la voie biliaire principale dans l’intestin grêle : on parle d’anastomose bilio-digestive,
- aboucher le pancréas restant soit dans l’estomac soit dans l’intestin grêle : on parle alors d’anastomose pancréatico-gastrique ou pancréatico-jéjunale.
- Pour les tumeurs du corps ou de la queue du pancréas, l’intervention consiste à retirer la partie gauche du pancréas ainsi que la rate dont les vaisseaux passent au contact du pancréas ; cette intervention s’appelle la spléno-pancréatectomie gauche. Il s’agit d’une intervention plus simple que la précédente car il n’y a pas à refaire le circuit digestif, biliaire et pancréatique. L’intervention se termine par la fermeture des différents plans musculaires et de la peau par des fils.
- Pour certaines tumeurs diffuses dans le pancréas qui sont précancéreuses ou à un stade très précoce de cancérisation (situation très rare), on peut discuter une pancréatectomie totale ; celle-ci entraîne une insuffisance exocrine et un diabète obligatoires qui doivent être corrigés.
Que ressent-on immédiatement après l’opération ?
Lorsque le patient opéré regagne sa chambre, plusieurs « tuyaux » ou « tubes » sont reliés à son corps.
- Une sonde nasale fixée à l’une de ses narines permet de lui délivrer de l’oxygène pendant les quelques heures qui suivent sa sortie de la salle d’opération.
- La sonde gastrique fixée à l’autre narine, et qui descend dans l’estomac, permet d’aspirer les sécrétions gastriques afin d’éviter d’éventuels vomissements durant les 12 premières heures et de protéger les sutures (coutures) digestives récemment effectuées lors de l’opération.
- Une sonde urinaire permet d’assurer la bonne vidange de la vessie pendant 1 à 3 jours.
- La perfusion, généralement administrée dans une veine du bras, permet d’apporter au patient les liquides (ou solutions) qui garantissent son hydratation et sa nutrition et de lui injecter des médicaments contre les douleurs causées par l’opération. La perfusion peut être enlevée après la reprise du transit, qui autorise à nouveau le patient à prendre des aliments solides, en général au bout de 3 à 4 jours. L’apparition de gaz signe la reprise du transit. Il n’est pas rare de ne pas avoir de selles pendant les 7 à 10 premiers jours suivant l’intervention. Les premières matières fécales peuvent être diarrhéiques avec parfois des traces de sang.
La douleur que le patient est susceptible de ressentir à la suite de l’intervention est prise en considération dès la sortie de la salle d’opération. Elle est évaluée et traitée dès le passage en salle de réveil. Les doses d’antalgiques (médicaments antidouleurs de la famille des morphiniques le plus souvent) sont adaptées aux besoins du patient opéré. Souvent, on propose au patient de contrôler lui-même leur administration avec une pompe qu’il active quand il en ressent le besoin. Au bout de 3 jours, il est généralement possible de substituer des antalgiques « mineurs », administrés par la bouche, aux dérivés de la morphine.
Quelles sont les complications aiguës possibles de la chirurgie ?
La chirurgie du pancréas est une chirurgie délicate qui requiert une bonne expérience des opérateurs. La surveillance post-opératoire peut nécessiter un séjour en réanimation pendant quelques jours. La survenue de complications est toujours possible. Celles-ci sont dominées par les infections superficielles de la paroi du ventre, des hématomes (poches de sang) ou des lymphocèles (poches de lymphe)… Le traitement fait appel à des pansements locaux.
Une infection urinaire peut également survenir, favorisée par la présence de la sonde urinaire. Elle peut être facilement maîtrisée grâce à l’administration d’un traitement antibiotique pendant 8 jours.
Comme après toute intervention chirurgicale imposant une immobilisation, il existe un risque de phlébite (constitution d’un caillot de sang dans une veine des jambes). La prévention de cette complication repose sur des injections d’un médicament visant à f luidifier le sang appelé anti-coagulant. Celles-ci sont faites avec une fine aiguille dans la peau du ventre ou des cuisses pendant toute l’hospitalisation. Leur efficacité est renforcée grâce au port de bas de contention.
La complication majeure de la chirurgie pancréatique est la fistule. Elle se définit par une fuite de liquide pancréatique qui sort du pancréas à l’endroit où celui-ci a été coupé par le chirurgien. Elle peut créer une collection (sorte de poche de liquide pancréatique) dans le ventre, ou, plus rarement, dans la plèvre (sorte de sac transparent) qui entoure les poumons. Ces collections peuvent s’infecter et nécessiter une nouvelle intervention chirurgicale pour les vider.
Le risque de décès au décours de ces opérations est inférieur à 5 %. Il est un peu plus élevé chez les sujets très âgés et dans les centres dans lesquels un nombre trop faible d’opérations du pancréas sont réalisées chaque année.
Quelles sont les complications de la chirurgie à plus long terme ?
En cas de duodéno-pancréatectomie céphalique, l’ablation d’une partie de l’estomac et du duodénum peut occasionner une gêne pour faire de gros repas avec une digestion ralentie, notamment des graisses. L’intervention peut entraîner assez fréquemment une diarrhée par 2 mécanismes :
- « Motrice », du fait de la coupure nécessaire de petits nerfs qui freinent habituellement le transit intestinal lors des premières étapes de l’ablation de la tumeur (« dissection »). Les selles surviennent juste après les repas, sont impérieuses, liquides et peu abondantes. Il faut alors fragmenter les repas (faire 5 petits repas plutôt que 3 normaux) et éviter les repas trop importants. Il est souvent nécessaire d’avoir recours à des médicaments qui ralentissent le transit (« freinateurs du transit ») à prendre de façon préventive avant l’absorption d’aliments (et non pas après l’émission de selles, comme c’est généralement indiqué dans la notice d’utilisation plutôt dédiée aux gastroentérites infectieuses).
- L’autre cause d’une diarrhée est la diminution du volume du pancréas avec une réduction de la quantité d’enzymes sécrétées. Il en résulte une digestion insuffisante des graisses et des protéines. Les selles sont alors grasses (parfois « huileuses »), pâles et collent à la cuvette des toilettes. Elles s’accompagnent de ballonnement et gaz gênants. Ce type de diarrhée justifie la prise de gélules d’extraits pancréatiques au début et/ou au milieu de repas ou collations riches en protéines ou en graisses, et en quantité adaptée au nombre des repas dans la journée.
En cas de spléno-pancréatectomie, la rate a été retirée ; il existe alors une augmentation théorique de survenue de certaines infections, en particulier avec un germe appelé pneumocoque. C’est pourquoi le patient doit se faire vacciner contre le pneumocoque, l’haemophilus et le méningocoque de type C, au mieux avant l’intervention (puis en effectuant un rappel 3 ans après), et prendre des antibiotiques (pénicilline) pendant 2 ans selon des modalités expliquées par le chirurgien qui l’a opéré. L’autre risque de cette opération est la survenue d’un diabète (inférieur à 10% des cas).
Pourquoi recevoir un traitement complémentaire si la tumeur a été totalement enlevée par la chirurgie ?
Lorsque la chirurgie du cancer du pancréas a permis d’enlever complètement la tumeur et les ganglions visibles, un traitement complémentaire par chimiothérapie est systématiquement proposé. Ce traitement est dit « adjuvant », car il vise à compléter le traitement chirurgical. En effet, il est possible que des foyers microscopiques de cellules tumorales, non détectables par les examens d’imagerie ou par le chirurgien, soient restés en place ou soient partis de la région du pancréas. Aussi, par sécurité, on vise à les détruire avec la chimiothérapie complémentaire appelée « adjuvante ». Celle-ci dure 6 mois. Idéalement, elle doit débuter au plus tard dans les 2-3 mois qui suivent la chirurgie.
Dans le cas de figure où la tumeur a été retirée en totalité et où l’analyse anatomo-pathologique a conclu que l’exérèse était complète, il a été démontré que l’administration d’une chimiothérapie adjuvante diminuait le risque de rechute et augmentait l’espérance de vie à long terme. En revanche, la radiothérapie n’est pas indiquée en dehors d’essais thérapeutiques. On peut la discuter toutefois si le compte-rendu anatomopathologique a conclu que l’exérèse n’a pas été complète ou est passée trop près de la tumeur.
Il est démontré que la chirurgie seule ne permet pas d’obtenir des résultats satisfaisants et qu’en l’absence de chimiothérapie, le risque de rechute est plus important. L’association recommandée à l’heure actuelle est la réalisation de la chirurgie puis de la chimiothérapie, mais il peut être proposé d’inverser la séquence de traitement en réalisant d’abord la chimiothérapie (appelée alors chimiothérapie néoadjuvante ou chimiothérapie d’induction), puis la chirurgie. L’objectif étant de réaliser au total, la chirurgie du cancer et 6 mois de chimiothérapie (avant, après, ou avant et après).
2. La chimiothérapie
Qu’est-ce que la chimiothérapie ?
La chimiothérapie est un traitement utilisant des médicaments anticancéreux.
Ces médicaments ont pour but de détruire les cellules cancéreuses ou d’empêcher leur prolifération.
Les cellules cancéreuses sont des cellules anormales qui se divisent rapidement et engendrent d’autres cellules anormales sans contrôle.
Il existe plusieurs types de médicaments anticancéreux qui interfèrent avec le développement des cellules soit pendant leur multiplication (les traitements sont appelés antimitotiques, la mitose signifiant la division de la cellule avec naissance de 2 cellules filles) soit pendant la phase de fabrication de l’ADN. Ces médicaments peuvent aussi affecter les cellules saines, d’où une possible baisse des globules blancs, des globules rouges et des plaquettes et les possibles autres toxicités ou effets secondaires observés pendant la chimiothérapie.
Un point important est de dédramatiser le terme de chimiothérapie.
Il ne faut pas considérer la chimiothérapie comme un traitement « extraordinaire ». Il s’agit d’un traitement comme un autre utilisant des médicaments ayant une activité et une toxicité propres.
Il est très important de parler de ses craintes avec l’équipe soignante qui en a une grande habitude et peut facilement donner des informations rassurantes.
Ainsi le patient doit se sentir libre de poser au médecin ou à l’infirmière toutes les questions qu’il souhaite. Il n’y a pas de question « inutile » ou « idiote » ! Il est important d’en faire une liste avant le rendez-vous, car l’émotion du patient et le temps limité de la consultation peuvent favoriser les oublis.
Quels sont les différents types de chimiothérapie utilisés dans le cancer du pancréas ?
Les médicaments utilisés en chimiothérapie dans le traitement du cancer du pancréas sont :
- les antimétabolites (gemcitabine, 5-fluorouracile ou 5-FU et capécitabine) qui inhibent la fabrication (synthèse) des protéines et la réplication de l’ADN en bloquant les enzymes clés de ces mécanismes et en s’incorporant « frauduleusement » dans les acides nucléiques (ADN et ARN) présents dans le noyau de la cellule tumorale. Ces médicaments privent en quelque sorte les cellules des moyens de se diviser, provoquant ainsi leur destruction car elles sont plus sensibles que les cellules normales puisqu’elles sont en état de multiplication constante. Ces médicaments sont administrés selon les cas par voie intraveineuse (gemcitabine et 5-FU) en perfusion ou par voie orale (par la bouche) pour la capécitabine,
- les dérivés du platine qui ont pour action d’empêcher la réplication de l’ADN entraînant ainsi la mort de la cellule cancéreuse. Les dérivés du platine utilisés dans le cancer du pancréas sont l’oxaliplatine, le carboplatine ou le cisplatine,
- les inhibiteurs d’une enzyme appelée topoisomérase I qui dérèglent la structure de l’ADN des cellules tumorales. Il s’agit de l’irinotécan. Certains produits sont donnés en association. Les sels de platine (oxaliplatine) ou l’irinotécan sont associés au 5-FU. Ces associations sont couramment appelées respectivement « FOLFOX » ou « FOLFIRI » (5-Fu, acide fOLinique [vitamine B9 donnée pour augmenter l’efficacité du 5-FU] et OXaliplatine ou IRInotécan). Depuis 2011, on propose à certains patients l’association de 3 molécules (5-FU, irinotécan et oxaliplatine) dans certaines situations. Cette association s’appelle « FOLFIRINOX ».
- récemment (janvier 2013), un nouveau produit, le nab-paclitaxel (nano particules composées de molécules cytotoxiques liées à l’albumine) associé à la gemcitabine a montré son efficacité et sa supériorité à la gemcitabine en monothérapie pour les patients atteints d’un cancer du pancréas métastatique. Cette association a obtenu une Autorisation de Mise sur le Marché -AMM-.
- de même un nouveau produit, le Nal-IRI (nano particules composées d’irinotécan liposomal) associé au 5-FU a montré son efficacité et sa supériorité au 5-FU en monothérapie pour les patients atteints d’un cancer du pancréas métastatique après échec d’une première ligne de traitement. Cette association a obtenu une Autorisation de Mise sur le Marché -AMM-.
- cependant ces 2 dernières molécules sont parfois difficiles à obtenir en France en raison d’un mauvais remboursement par l’assurance maladie aux hôpitaux qui les utilisent.
Les médecins décident, au cours d’une RCP, un protocole de chimiothérapie composé des médicaments qu’ils jugent les plus adaptés à chaque patient en fonction des connaissances scientifiques et des éventuelles contre-indications à tel ou tel médicament. Ils peuvent également proposer au patient de participer à une étude clinique. Les modalités d’administration des traitements (durée, fréquence) varient alors selon les protocoles.
Dans quels cas la chimiothérapie est-elle conseillée ou nécessaire ?
La chimiothérapie peut être conseillée et proposée dans 3 situations en cas du cancer de pancréas exocrine.
- La chimiothérapie « néo-adjuvante » est réalisée avant un éventuel traitement chirurgical. Elle a pour objectif de faciliter la chirurgie, en particulier en cas de tumeur sans métastases mais difficilement enlevable pour en diminuer la taille, afin d’en faciliter l’exérèse.
- La chimiothérapie « adjuvante » est réalisée après l’acte chirurgical ; elle est détaillée plus haut (voir question 17).
- La chimiothérapie pour tumeur dite « avancée » est administrée lorsqu’ il n’y a pas d’ablation envisagée, le plus souvent du fait de la présence de métastases à distance, d’un développement locorégional important, ou d’une rechute après une opération. Son objectif est alors d’augmenter la durée de vie du patient et d’améliorer son confort (« qualité de vie »), en empêchant ou en retardant la survenue de symptômes désagréables (douleurs, troubles digestifs avec amaigrissement ou jaunisse, en particulier).
La première chimiothérapie administrée à un patient pour tumeur avancée est dite de « première ligne ». Si celle-ci n’est plus (ou pas) efficace, l’administration d’une « seconde ligne » est discutée par les médecins en RCP. On peut ainsi être amené à proposer plusieurs lignes de chimiothérapie en fonction de l’évolution de la maladie, de l’état général et de la motivation du patient.
Combien de temps dure la chimiothérapie ?
La chimiothérapie est administrée sous forme de cycles ou cures. Chaque cycle a une durée variant d’une demi-journée à 2 jours selon les protocoles, suivi d’une période de repos de 6 à 12 jours pendant laquelle le patient peut se reposer et ses cellules normales peuvent se régénérer. Puis, le cycle est répété.
Les médecins choisissent le protocole le mieux adapté à chaque patient. Il est choisi en fonction d’un certain nombre d’éléments, tels que le stade du cancer, l’état général du patient, les médicaments les plus efficaces et les moins toxiques dans une situation donnée, les autres traitements reçus antérieurement ou pendant la chimiothérapie, etc… Il est très important de respecter aussi rigoureusement que possible le protocole de traitement. C’est la condition indispensable pour obtenir le meilleur résultat.
La chimiothérapie « adjuvante » dure 6 mois et la chimiothérapie « néo-adjuvante » a une durée limitée dans le temps (en général, de 2 à 6 mois). La durée des chimiothérapies pour maladie avancée ne peut être déterminée à l’avance : le traitement doit être administré aussi longtemps qu’il est efficace (des évaluations régulières sont prévues) ; on est souvent conduit à faire des modifications de chimiothérapie au cours de l’évolution de la maladie. Il est cependant possible après une assez longue période de traitement, quand la maladie est contrôlée, de ménager des pauses qui permettent au patient de se reposer et de partir en vacances, par exemple.
Quels sont les effets secondaires de la chimiothérapie ?
Comme tous les médicaments, les chimiothérapies peuvent donner des effets « indésirables » appelés encore « secondaires ».
Leur survenue n’est pas systématique mais elle est fréquente. Leur intensité et leur sévérité sont assez variées d’une personne à l’autre. Ils sont rarement graves. On dispose maintenant de nombreux médicaments qui permettent d’atténuer, voire d’empêcher complètement, la plupart des effets secondaires. Le médecin les prescrit selon le type du protocole et les adapte en fonction de la tolérance individuelle du patient.
Le médecin responsable de la chimiothérapie doit informer le patient des effets secondaires provoqués par le protocole administré. Les infirmier(e)s peuvent également aider les patients à les reconnaître et à les gérer.
Pendant toute chimiothérapie, il existe un risque temporaire de baisse des globules blancs (avec un risque d’infection) et des plaquettes (risque d’hémorragie). Une prise de sang avant chaque cycle est nécessaire afin de juger si la cure peut être réalisée ou non. Si les globules ou les plaquettes sont trop bas, le médecin peut décider de retarder le traitement, et si c’est nécessaire, d’en diminuer les doses.
Voici une liste des effets secondaires les plus fréquents que l’on peut observer avec les principaux médicaments de chimiothérapie utilisés dans les cancers du pancréas :
- Gemcitabine : elle est en général bien tolérée. Les effets indésirables pouvant survenir sont : fièvre, frissons et douleurs musculaires (ressemblant aux symptômes d’une grippe légère) survenant habituellement dans les 48h suivant la perfusion, fatigue, perte d’appétit, nausées ou vomissements.
- 5-fluorouracile et capécitabine : diarrhée, ulcérations dans la bouche ressemblant à des aphtes (appelées « mucites »), modification de la peau des mains et des pieds (rougeurs, petites ulcérations et/ou peau qui pelle comme après un coup de soleil) et (très rarement) douleurs thoraciques d’origine cardiaque imposant l’arrêt immédiat du traitement. Les modifications de la peau des mains et des pieds sont plus fréquentes, et en général plus sévères avec les formes orales de 5-fluorouracile (capécitabine). Elles requièrent l’administration d’une crème grasse. En France aujourd’hui on vérifie qu’une enzyme du corps appelée DPD (dihydro-pyrimidine déhydrogénase) fonctionne bien par une prise de sang avant administration de 5FU ou de capécitabine. En effet, si le patient est déficitaire pour cette enzyme (moins de 1% des Français) ces molécules ne pourraient pas être utilisées car elles seraient trop toxiques.
- Oxaliplatine : neuropathie sensitive (sorte de fourmillement des mains, des pieds ou du visage, déclenchés par l’exposition au froid). Cette neuropathie augmente au fur et à mesure des cycles, mais est réversible dans la très grande majorité des cas à l’arrêt de l’oxaliplatine. Il n’y a pas de traitement préventif. Le médicament doit impérativement être stoppé quand les symptômes sont sévères, c’est-à-dire quand les fourmillements ou l’impression de carton deviennent permanents ou qu’apparaît une gêne fonctionnelle des doigts ou des pieds altérant la vie courante ou même que les fourmillements ne sont plus déclenchés par le froid et deviennent permanents. Cette neuropathie peut mettre un certain temps à régresser après l’arrêt de l’oxaliplatine.
- Irinotécan et Nal-IRI : fatigue, diarrhée, syndrome vagal, perte transitoire des cheveux.
- Nab-paclitaxel : neuropathies sensitives, réversibles dans la plupart des cas à l’arrêt du traitement, fatigue, perte transitoire des cheveux.
Certains effets secondaires, comme la perte de cheveux (toujours temporaire), sont souvent redoutés par les patients mais ne mettent pas la vie en danger. Le risque de chute des cheveux peut être diminué (en cas de chimiothérapie à risque d’alopécie), par le port d’un casque réfrigérant pendant le traitement, mais il est contre-indiqué avec l’Oxaliplatine. D’autres moins connus et donc moins redoutés par les patients sont potentiellement plus graves et doivent être bien expliqués par le médecin.
Le protocole de chimiothérapie FOLFIRINOX a une toxicité un peu plus élevée que les autres traitements ; cela explique qu’il soit réservé à des patients en bon état général, et n’ayant pas de troubles importants des fonctions du foie.
D’autres recommandations indispensables doivent être ajoutées. En cas de fièvre supérieure à 38°5 à distance de la fin de la chimiothérapie ou de saignement (des gencives, du nez ou hématomes sur la peau…), il faut impérativement faire une prise de sang en urgence. Si celle-ci montre une baisse importante des globules blancs et/ou des plaquettes, il faut contacter immédiatement le médecin qui pourra décider d’une hospitalisation en urgence pour administrer des antibiotiques par voie veineuse (en cas de baisse des globules blancs) ou, exceptionnellement, une transfusion de plaquettes (en cas d’hémorragie).
En cas de vomissements entraînant une impossibilité de s’alimenter et surtout de boire, il est indispensable de contacter le médecin pour qu’il puisse juger de la nécessité d’une hospitalisation pour réhydrater le patient, généralement par des perfusions.
En cas de douleurs dans la poitrine pendant un traitement par 5-fluorouracile ou par capécitabine, il faut immédiatement arrêter le système de perfusion autonome (le médecin doit expliquer comment) ou la prise de comprimés et consulter soit aux urgences de l’hôpital le plus proche, soit dans le service où le patient est pris en charge pour faire un électrocardiogramme.
Les effets secondaires de la chimiothérapie ne surviennent pas systématiquement mais il ne faut pas les négliger. Les conseils donnés dans ce chapitre ne doivent pas dispenser le patient d’une information complète qui sera faite par l’équipe soignante. Le patient doit alors discuter avec elle en cas de symptômes jugés inhabituels et bien décrire les effets secondaires subis : ceci permettra d’adapter les médicaments prescrits pour les éviter ou les atténuer dans le futur.
Comment se passe la chimiothérapie ?
Pour traiter les cancers du pancréas, la chimiothérapie est le plus souvent administrée par voie injectable et plus rarement par voie orale (sous forme de comprimés). Les médicaments de chimiothérapie sont diffusés dans tout le corps au travers du sang et peuvent ainsi arriver au niveau des divers organes possiblement atteints par le cancer.
On utilise le plus souvent un cathéter implanté pour faciliter les perfusions.
Les traitements sont administrés de façon standardisée, d’où le nom de protocole. Celui-ci est écrit et signé par le médecin (la prescription est actuellement fréquemment faite par informatique) puis mis en place par l’infirmière. Les doses des médicaments anti-cancéreux sont adaptées au poids et à la taille de chaque patient. Elles doivent donc être diminuées en cas d’amaigrissement. Le patient devra signaler tout amaigrissement de plus de 10 % au médecin ou à l’infirmière. Ces protocoles respectent des indications et des contreindications spécifiques. Les patients sont vus régulièrement avant chaque cycle avec une prise de sang pour vérifier que le nombre de globules blancs et de plaquettes autorise la réalisation de la cure, et pour adapter si besoin le traitement en cas de problème de toxicité.
Des bilans sont également effectués à intervalle régulier (en général tous les 2 à 3 mois) pour vérifier l’efficacité du traitement. Le médecin s’aidera pour cela d’examens d’imagerie (en général un scanner) et d’examens biologiques (bilan du foie, marqueurs tumoraux sanguins).
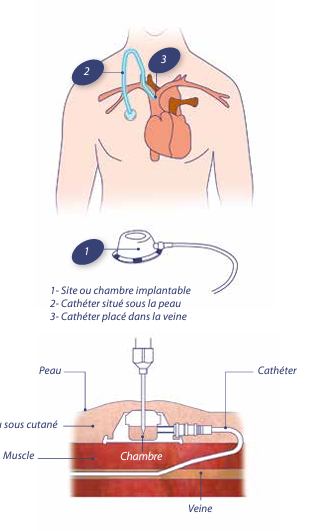
Qu’est-ce qu’un cathéter, une chambre implantable, un PAC, un cathéter central ?
Un cathéter est un tuyau stérile très fin introduit le plus souvent dans une veine de la base du cou. Le cathéter permet d’administrer rapidement des médicaments de chimiothérapie par les veines. Il évite de faire une piqûre dans le bras du patient lors de chaque cure de chimiothérapie. Il peut aussi être utilisé pour injecter d’autres médicaments que la chimiothérapie (antibiotiques, médicaments contre les vomissements, transfusions, etc.) ou plus rarement pour effectuer des prélèvements de sang. Il doit toujours être manipulé de façon stérile étant donné le risque infectieux inhérent à des utilisations multiples. Pour éviter que le cathéter se bouche avec un caillot, on le rince généralement en fin d’utilisation.
Le cathéter est en général placé sous anesthésie locale après confection d’1 ou 2 petites cicatrices sur le thorax et sur le cou.
Il existe 2 types de cathéters :
- le cathéter veineux central est introduit dans la veine située sous la clavicule. Un pansement est ensuite nécessaire pour protéger la zone de sortie du cathéter.
- le cathéter à site d’injection implantable (appelé aussi dispositif intraveineux : D.I.V, ou encore port-a-cath : PAC). Ce cathéter est relié à un petit réservoir en plastique ou en titane (la chambre implantable) qui est placé sous la peau et raccordé à un tuyau (le cathéter) placé dans la veine sous-clavière ou la veine jugulaire. Une incision au-dessus de la clavicule de 3- 4 cm est nécessaire, et des points de suture maintiennent ensuite le système en place. C’est généralement ce dispositif qui est systématiquement proposé lors de chimiothérapies prolongées. Une fois le système mis en place, il suffit de piquer à travers la peau dans la chambre implantable (au travers d’une membrane en plastique étanche) pour mettre directement en communication le flacon de perfusion et le système veineux.
Comment fonctionne le diffuseur portable permettant l’administration de certaines chimiothérapies au domicile après la mise en place à l’hôpital ?
Le développement de la chimiothérapie anticancéreuse en ambulatoire fait appel à un moyen spécifique d’administration: le diffuseur portable (utilisé lors des chimiothérapies de type FOLFOX, FOLFIRI ou FOLFIRINOX).
Qu’est-ce qu’un diffuseur ?
Un diffuseur est un dispositif de perfusion continue, muni en son centre d’un ballon contenant l’anticancéreux. Il existe différentes tailles de diffuseur. Le contrôle de l’administration du médicament est permis par la réduction du diamètre du ballonnet reporté à une échelle visuelle graduée.
Le ballonnet en silicone (ou réservoir) contient le médicament (5-FU). Au début de l’administration, le ballon est gonflé et le médicament est visible à travers ce ballon. Lorsque l’administration est terminée, le ballonnet est dégonflé et plaqué contre l’axe central de la coque de protection. La coque de protection assure la protection du dispositif. Cette coque possède un orifice de ventilation, permettant à l’air de rentrer quand le réservoir se vide. En raison de cet orifice, de l’eau pourrait rentrer dans la coque. C’est pourquoi le diffuseur ne doit pas être trempé ni immergé dans l’eau (voir plus loin, douche ou bain). Si le cas se présentait, cela entraînerait de la condensation qui disparaîtrait.
Situé au deux tiers de la tubulure, un filtre à air et à particules permet l’élimination des bulles d’air et des particules éventuellement contenues dans le ballonnet.
Il ne faut jamais obstruer cet orifice (sparadrap, pansement, etc…) ni l’immerger dans l’eau car cela risque d’arrêter la perfusion. Le clamp permet d’arrêter l’administration de l’anticancéreux. En poussant sur le clamp, la tubulure est pincée et l’administration s’arrête.
Comment fonctionne le diffuseur ?
Le médicament en solution se trouve à l’intérieur d’un réservoir (ballon). Une fois le ballon rempli, celui-ci exerce une pression qui diffuse le médicament dans la tubulure reliée à la chambre implantable. Le diffuseur fonctionne par pression continue dans le ballon sans pile ni branchement électrique.
La vitesse de perfusion peut-elle être modifiée ?
Le diffuseur est conçu pour se vider très lentement (environ 2 ml/heure ou 5 ml/heure, suivant le dispositif ) avec une durée d’administration pouvant varier de 10 à 15 %.
Le débit est déterminé par le régulateur de débit qui se trouve à la fin de la tubulure ; il est préréglé lors de la fabrication du diffuseur et ne pourra pas être modifié.
Cependant, plusieurs facteurs peuvent influencer la vitesse de perfusion…
La température
Les variations de température influencent la vitesse de perfusion. La chaleur augmente la vitesse de perfusion alors que le froid la diminue. Pour diffuser au même débit, le diffuseur doit être placé à température ambiante (entre 20° et 27°).
Ainsi, le patient ne doit pas rester trop près d’un radiateur ou d’un feu de cheminée, ni poser une bouillotte sur le diffuseur. A l’inverse, en hiver, il faut le protéger du froid près du corps, sous les vêtements.
L’emplacement
En raison de la force de gravité, le fait de poser le diffuseur par terre ralentit la perfusion ; à l’inverse, le placer en hauteur augmente la vitesse de perfusion.
Il faut donc le garder au même niveau que le cathéter.
La tubulure
Il faut s’assurer qu’au lever et au coucher, la tubulure ne soit ni coudée ni entortillée.
Il est rappelé que l’écoulement du liquide est très lent. Selon le type de diffuseur prescrit, celui-ci prendra environ 48 à 120 heures pour se vider.
Le médecin ou l’infirmier précise toujours, lors de la mise en place du diffuseur, la durée de la perfusion.
Comment savoir si la perfusion est terminée ou pas ?
Lorsque l’administration est terminée, le ballon est dégonflé et plaqué contre l’axe central.
Une petite quantité de médicament, jusqu’à 5 ml peut toutefois rester dans le diffuseur.
Que faire en cas de présence de bulles dans le ballonnet du diffuseur ?
Il est normal de voir quelques bulles d’air dans le réservoir du diffuseur. Cet air sortira par l’orifice situé au niveau du filtre. Il ne faut jamais obstruer cet orifice (sparadraps, pansements…) ni le mouiller car cela risque d’arrêter la perfusion.
Peut-on prendre un bain ou une douche avec le diffuseur ?
Il est possible de prendre un bain ou une douche mais certaines recommandations sont importantes à suivre :
- lors de la douche, il est important de ne pas diriger le jet sur le diffuseur et le filtre. Il peut être accroché hors de la douche, grâce à sa pince ou protégé en l’emballant dans un sac plastique.
- lors d’un bain, il faut éviter que la tubulure et le diffuseur ne trempent dans l’eau.
Où mettre le diffuseur lorsque le patient dort ?
Il ne doit pas être posé sur le sol ni être suspendu au-dessus de la tête. De nombreux patients choisissent de glisser leur diffuseur sous leur oreiller ou de le placer sur leur table de nuit.
Quelle est la meilleure façon de porter le diffuseur pendant la journée ?
Une pince « crocodile » est souvent fixée sur le dessus du diffuseur. Elle permet d’accrocher le diffuseur aux vêtements. Des étuis de transport, à porter autour de la taille afin de ne pas être gêné dans ses mouvements sont aussi proposés. Il faut veiller à protéger le dispositif portable de la lumière solaire directe, des températures élevées ou basses (<15°c).
Comment reconnaître une fuite de 5-FU au niveau du diffuseur et que faire en cas de fuite ?
Reconnaître une fuite : en séchant, le 5-FU laisse des cristaux blancs persistants, contrairement à la condensation où les traces d’eau sont incolores et vont disparaître.
En cas de fuite : ne pas manipuler le liquide médicamenteux à mains nues mais mettre une paire de gants. Il faut aussi vérifier que les connections sont bien vissées (verrouillage).
Si la fuite persiste, il faut alors clamper le diffuseur (en poussant sur le clamp, de façon à ce que la tubulure soit pincée) et téléphoner à l’équipe soignante afin de connaître la conduite à tenir.
Rappel des recommandations :
- éviter les expositions au froid et au chaud,
- ne pas rester trop près d’une source de chaleur (radiateur, feu de cheminée), ni poser une bouillotte sur le diffuseur,
- ne pas mouiller ni immerger le diffuseur ou la tubulure,
- ne pas obstruer l’orifice du filtre à air (par un pansement etc…),
- ne pas entortiller la tubulure ni la couder,
- ne pas toucher aux liquides biologiques pendant l’administration et jusqu’à 24 h après l’administration,
- en cas de contact de l’anticancéreux avec la peau, laver soigneusement au savon et rincer abondamment.
Une hospitalisation est-elle nécessaire pour recevoir une chimiothérapie ?
La plupart des traitements utilisés dans les cancers du pancréas peuvent être faits en hôpital de jour ou centre de chimiothérapie dite ambulatoire, c’est-à-dire sans passer la nuit à l’hôpital.
Les lits et fauteuils de chimiothérapie ambulatoire permettent d’administrer un traitement qui va débuter dans un cadre hospitalier où le patient est surveillé par une infirmière spécialisée.
Puis, en fonction du protocole choisi, le traitement pourra se poursuivre à la maison grâce à un diffuseur (appelé aussi infuseur, voir question 25), sorte de petit réservoir portatif, de la taille d’un cercle de 10 centimètres de diamètre qui administre automatiquement la chimiothérapie.
3. La radiothérapie
Que sont la radiothérapie et la chimio-radiothérapie ?
La radiothérapie est un traitement médical qui consiste à administrer des rayons (on appelle cela des rayonnements ionisants) sur une région du corps donnée. Il s’agit le plus souvent d’un faisceau de rayons X (photons) produits par une machine appelée accélérateur linéaire de haute énergie. Ce rayonnement va entraîner des lésions de l’ADN au niveau des cellules tumorales visées et entraîner leur destruction.
La chimio-radiothérapie consiste à associer une chimiothérapie à la radiothérapie précédemment décrite, les 2 traitements étant administrés en même temps (chimiothérapie concomitante). La chimiothérapie comporte un ou plusieurs produits toxiques pour les cellules tumorales. Son administration peut être orale ou par perfusion selon le type de chimiothérapie. Le fait d’associer la chimiothérapie à la radiothérapie permet souvent une meilleure efficacité que la radiothérapie seule car la chimiothérapie va rendre les cellules tumorales encore plus vulnérables aux rayons.
Dans quels cas fait-on une chimio-radiothérapie ?
La chimio-radiothérapie pour traiter un cancer du pancréas peut être envisagée par l’équipe médicale dans 2 situations qu’il est important de distinguer :
- dans le cas de figure où la tumeur est résécable mais que le risque de résection incomplète est important (tumeur dite «borderline» ou à la limite de la résécabilité). Dans ce cas, le traitement commencera souvent par une chimiothérapie suivie ensuite en fonction de la réponse par une chimio-radiothérapie ou une radiothérapie stéréotaxique afin d’améliorer les chances de résection complète de la tumeur et donc les chances de guérison.
- dans le cas de figure où la tumeur n’est pas résécable, elle est alors dite « localement avancée ». L’équipe médicale peut proposer dans un premier temps une chimiothérapie puis dans un deuxième temps, une radiothérapie le plus souvent associée à une chimiothérapie par voie orale (comprimés) afin de détruire la tumeur le plus complètement possible. Dans certains cas, s’il existe une bonne efficacité de la chimio-radiothérapie, un traitement par chirurgie peut être ensuite envisagé. Dans d’autres cas, seule la chimio-radiothérapie sera réalisée et permettra au patient d’être ensuite surveillé sans chimiothérapie. La chimiothérapie devra en revanche être reprise si lors de cette surveillance, la maladie venait à ré-évoluer.
La radiothérapie peut également être utile dans d’autres situations comme l’existence de métastases osseuses (localisation secondaire du cancer au niveau d’un os), la radiothérapie étant efficace pour diminuer la douleur liée à ces métastases.
Quelles sont les modalités techniques de la radiothérapie et de la chimio-radiothérapie ?
Avant de réaliser la radiothérapie, plusieurs étapes sont indispensables :
- la consultation avec l’oncologue radiothérapeute : celui-ci pose ou confirme l’indication de radiothérapie et explique le principe du traitement, ce qu’on en attend, ses modalités et ses possibles effets secondaires.
- la réalisation d’un scanner de simulation afin de délimiter la zone tumorale à irradier. Le scanner est réalisé dans une position donnée qui devra toujours être la même ensuite, pendant la radiothérapie. Dans le même temps, des repères sont placés au niveau de la peau (points de tatouage ou traits au stylo feutre). Cette étape s’appelle le centrage. Pour les tumeurs du pancréas qui sont mobiles avec la respiration, un scanner 4D (en 4 dimensions, qui prend en compte le temps) est le plus souvent ensuite réalisé. C’est un scanner un peu plus long qui grâce à un boitier placé sur la poitrine permet d’évaluer l’amplitude des mouvements de la tumeur liés à la respiration et ainsi de définir des marges sur mesure pour chaque patient. Ainsi, la tumeur traitée sera toujours dans les faisceaux d’irradiation tout le long du traitement. Dans certains cas, afin d’améliorer la précision du ciblage de la tumeur, des grains d’or visibles au scanner ou à la radio sont mis en place dans le pancréas lors d’une échoendoscopie faite avant le centrage. Il ne sera pas nécessaire de les enlever ensuite.
- la dosimétrie est ensuite réalisée : il s’agit de calculs et de simulations sur ordinateur qui permettent de répartir la dose de rayons afin d’irradier au mieux la tumeur et de diminuer au maximum l’irradiation des zones saines. Ces données, une fois validées par le radio-physicien et l’oncologue radiothérapeute, sont transférées à la machine de traitement.
Après ces étapes préalables, le traitement peut débuter : installation du patient sous la machine et réalisation du traitement qui est indolore. La bonne position du patient est vérifiée à chaque séance de traitement.
Les séances de radiothérapie ont lieu en général 1 fois par jour, 5 jours sur 7 pendant 2 à 6 semaines selon l’indication. Les séances n’excèdent pas 10 minutes. Ainsi, avec le temps d’installation et d’attente dans le service, le patient passe environ 30 minutes dans le service par jour.
Pour les tumeurs très mobiles, un asservissement respiratoire peut être utilisé : le traitement ne sera réalisé que dans certaines phases de la respiration, en inspiration par exemple, afin de diminuer le mouvement de la tumeur lié à la respiration.
En cas d’irradiation stéréotaxique, une technique de haute précision utilisant de multiples micro-faisceaux se croisant au niveau de la tumeur, il n’y aura que 4 à 8 séances souvent réalisées un jour sur deux. Celles-ci sont un peu plus longues mais tout aussi indolores.
Ces séances sont réalisées par des techniciens en radiothérapie, appelés manipulateurs en électroradiologie. À chaque séance, le manipulateur installe le patient sur la table de traitement puis effectue les vérifications nécessaires.
Lors de la radiothérapie proprement dite, le patient est seul dans la salle de traitement, sous surveillance audiovisuelle. Il est très important que le patient reste totalement immobile pour que le traitement soit d’une qualité optimale.
Le patient n’est pas « radioactif » en sortant de la séance de radiothérapie. Il peut donc rester au contact de nourrissons, de femmes enceintes, de personnes âgées, ou de personnes « fragiles » sans danger pour eux.
Si le patient n’est pas hospitalisé, il devra faire le trajet de manière quotidienne (par ses propres moyens s’il le souhaite ou par un taxi ou par un véhicule sanitaire).
Quels sont les effets secondaires de la chimio-radiothérapie ? Comment les prévenir et comment les traiter ?
Les effets secondaires de la radiothérapie dépendent de la dose délivrée, de la zone traitée mais également du patient. La majorité des patients ne seront pas du tout gênés, d’autres présenteront des troubles parfois importants. Ces effets secondaires sont liés à l’inflammation induite par les rayons. Au cours de la radiothérapie, la rencontre avec l’oncologue radiothérapeute en consultation de suivi a lieu 1 fois par semaine de manière systématique et en cas de besoin à la demande : il ne faut donc pas hésiter à le solliciter.
Voici les principaux effets secondaires imputables à la radiothérapie.
- La fatigue : elle est autant liée à la radiothérapie qu’aux déplacements pour celle-ci. La fatigue peut être majorée par une chimiothérapie concomitante. Il est indispensable de se réserver des périodes de repos au cours de la journée.
- Les douleurs abdominales et brûlures d’estomac : elles peuvent être parfois importantes mais ne sont pas systématiques. Elles surviennent en général après 2 semaines de traitement. Le médecin prescrit dans ce cas des médicaments antalgiques adaptés. Des médicaments diminuant la sécrétion acide gastrique sont recommandés pendant toute la durée de l’irradiation et pendant les 6 mois suivant celle-ci.
- Les nausées et vomissements : ces effets sont liés à l’action des rayons sur le plexus coeliaque, carrefour nerveux situé derrière l’estomac. Ils sont prévenus par des médicaments contre les nausées administrés systématiquement environ 1 heure avant la séance de radiothérapie.
- Le manque d’appétit : il est recommandé de fractionner les repas, de manger en petite quantité plus souvent, et d’utiliser des compléments nutritionnels.
- La diarrhée : elle est liée à l’irradiation du tube digestif. Elle est rare avec les techniques actuelles d’irradiation. Elle est maîtrisée grâce à des traitements anti-diarrhéiques classiques associés à des mesures diététiques. Demander l’avis de la diététicienne du service est conseillé.
Il ne faut pas oublier que ces effets secondaires disparaissent dans les semaines qui suivent l’arrêt du traitement.
4. Le traitement des complications du cancer du pancréas
Quelles peuvent être les complications du cancer du pancréas ?
Les complications possibles d’un cancer du pancréas sont les suivantes :
- douleurs,
- jaunisse ou ictère,
- vomissements,
- gonflement du ventre lié à une ascite (présence de
- liquide dans le péritoine),
- dénutrition,
- fatigue,
- anxiété ou dépression.
Ceci n’est qu’une liste : toutes ces complications ne surviennent pas systématiquement chez tous les malades !
Comment sont traitées les douleurs ?
Elles sont fréquentes au cours de cette affection car le pancréas est localisé dans une région riche en nerfs sensitifs, appelée plexus cœliaque. Elles révèlent souvent la maladie. De manière caractéristique, elles siègent au creux de l’estomac (région
épigastrique) et irradient vers le dos ou sous les côtes. Elles sont parfois intenses et prolongées. Leur prise en charge repose sur les traitements spécifiques de la tumeur (chirurgie, radiothérapie, chimiothérapie) et sur l’administration de médicaments anti-douleurs appelés antalgiques.
La chirurgie
L’existence de douleurs signale souvent une extension de la tumeur autour du pancréas. Dans le cas où la tumeur ne peut être enlevée, si une intervention a été effectuée (par exemple pour traiter une jaunisse ou une obstruction au niveau du duodénum par des dérivations biliaire et/ou digestive), le chirurgien peut injecter une solution d’alcool dans les plexus nerveux qui entourent le pancréas. Ce geste permet de
diminuer la douleur dans un nombre important de cas.
La chimiothérapie
Il a été montré que chez certains malades, l’administration d’une chimiothérapie est susceptible de traiter efficacement les douleurs en diminuant la taille de la tumeur, ce qui permet parfois de diminuer ou d’arrêter un traitement antalgique. Toutefois, un tel effet, lorsqu’il survient, est retardé (il faut attendre généralement au moins 1 mois
après le début de la chimiothérapie).
La radiothérapie ou chimio-radiothérapie
Ce traitement peut avoir un effet important sur les douleurs, même s’il peut entraîner parfois des effets secondaires (nausées ou vomissements, diarrhée ou fatigue transitoires).
Les antalgiques
Ils sont quasi systématiquement utilisés car ils sont très maniables. Les médicaments principalement utilisés sont appelés dérivés morphiniques. Comme leur nom l’indique, ils dérivent de la morphine synthétisée à partir d’une plante, le pavot (papaver somniferum). La morphine a longtemps eu une connotation péjorative dans l’esprit général, car assimilée à la fin de vie des malades ou à la toxicomanie.
En réalité, bon nombre de médicaments sont dérivés de la morphine et sont utilisés à très large échelle. Ils sont peu toxiques et peu coûteux. Les dérivés de la morphine sont généralement très efficaces sur les douleurs du cancer du pancréas à condition qu’ils soient administrés à doses adaptées. La voie orale doit être systématiquement
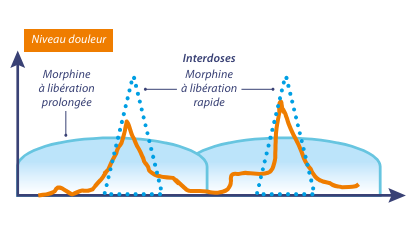
privilégiée. Les progrès des industriels qui fabriquent les médicaments ont permis de disposer de produits ayant des durées d’action très variées, adaptées à toutes les situations : efficacité rapide et action courte pour les douleurs aiguës (durant 3-4h), ou à libération prolongée ayant une action retardée et longue (12 h ou 24 h) voire très longue (72h) pour les douleurs stabilisées, en traitement prolongé.
Le traitement débute avec une dose dépendant du poids du malade (souvent 1 mg de morphine-équivalent par kg) qui est augmentée en fonction des besoins. Lorsqu’une morphine à action prolongée (dite LP pour libération prolongée) est administrée (en général une prise matin et soir), des doses de morphine à action rapide peuvent
être utilisées en cas de survenue de pics douloureux. On les appelle « interdoses » (voir schéma ci-dessous). Le nombre d’interdoses nécessaires devra faire adapter les doses de morphine LP.
D’autres modes d’administration que la voie orale par comprimés, gélules ou solutions sont possibles : patchs transdermiques, applicateurs buccaux, instillation nasale, injection sous-cutanée ou intraveineuse. Les avantages et inconvénients de chacun d’entre eux doivent être discutés avec des médecins spécialisés dans la prise en charge de la douleur.
Le but est de rendre le patient le plus autonome possible : il lui est prescrit des inter-doses qu’il choisit ou non de prendre selon les circonstances. Il s’agit généralement de cachets ou de gélules qu’il pourra prendre en fonction des besoins, à domicile.
En cas de fortes douleurs, une hospitalisation peut être nécessaire pour des injections de morphine par voie veineuse le plus souvent grâce à une pompe à morphine appelée PCA (Pompe AutoContrôlée). Le principe est l’administration séquentielle de petites
doses de morphine à la demande réalisée par le malade lui-même en fonction de ses besoins. La PCA n’est proposée qu’après « titration » de la douleur, c’est-à-dire après l’institution d’un traitement de fond efficace sur la majorité des douleurs. Les explications concernant le fonctionnement du dispositif et sa mise en place sont sous la responsabilité d’infirmières et de médecins ayant une grande habitude de cette technique. Ce traitement est d’ailleurs habituellement instauré dans une structure hospitalière mais il peut être poursuivi à domicile le cas échéant.
L’administration de dérivés morphiniques peut cependant entraîner des effets qu’il faut soigneusement prendre en charge :
- une constipation : celle-ci est quasiment constante et justifie la prise de laxatifs,
- une somnolence fréquente (ou une augmentation de la durée de sommeil) en début de traitement : elle est liée à l’effet du produit mais aussi au soulagement obtenu ; le patient qui dormait mal depuis plusieurs nuits à cause de la douleur récupère une « dette de sommeil ». Dans ce cas, il faut éviter la conduite d’engins motorisés et la prise simultanée d’alcool.
Beaucoup plus rarement…
- une envie de se gratter (appelée prurit),
- une difficulté à uriner (« globe vésical »),
- la survenue de contractions musculaires (appelées clonies), de troubles sérieux de la conscience ou de la respiration traduisent l’administration d’une dose excessive. Ils nécessitent un traitement rapide en milieu hospitalier.
- une dépendance à la morphine peut survenir (moins de 1 cas sur 10 000) chez les malades traités pour un cancer et qui reçoivent un traitement morphinique « classique » (comprimés, perfusion). Cette dépendance résulte en général d’une dose donnée au patient supérieure à ses besoins.
D’autres traitements médicamenteux peuvent être très utiles en association (voire d’efficacité parfois supérieure à celle des dérivés morphiniques chez certains patients) : les anti-inflammatoires (le cancer du pancréas est une tumeur très inflammatoire) ; les médicaments dits « neurotropes » ayant une action très efficace sur la composante
dite neurogène de la douleur (les douleurs neurogènes sont brèves et fulgurantes, telles qu’on peut les rencontrer dans le zona ou certaines compressions de nerfs). La destruction des plexus nerveux autour du pancréas peut être efficace sur les douleurs (voir paragraphe « chirurgie »). Elle peut aussi être réalisée sans chirurgie par injection d’alcool sous contrôle d’un scanner ou lors d’une écho-endoscopie par des équipes spécialisées.
Existe-t-il des douleurs rebelles au traitement ?
Avec les modalités thérapeutiques que nous venons de détailler, la grande majorité des douleurs peuvent être calmées grâce à une prescription adaptée. Lorsqu’elles sont rebelles, un conseil auprès de médecins spécialistes de la douleur doit être demandé.
Les traitements sont décidés au cas par cas (injection de dérivés morphiniques autour de la moelle épinière, etc.)
Des médecins et infirmiers ayant une compétence spécifique (centre anti-douleurs, équipes mobiles,…) peuvent apporter une aide précieuse au patient dans la prise en charge des douleurs.
Comment traite-t-on l’ictère (jaunisse) ?
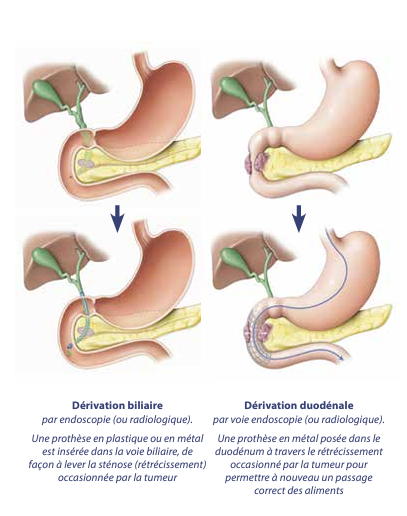
Ce symptôme est dû à un blocage du canal cholédoque (par lequel s’écoule la bile) par la tumeur. Il existe 2 manières de résoudre le problème lorsque la tumeur n’est pas enlevable par la chirurgie :
- Mise en place d’une prothèse généralement en métal dans la voie biliaire au cours d’une endoscopie digestive (par un gastroentérologue spécialisé pour ces techniques) ou sous contrôle d’une échographie ou d’un scanner (par un radiologue). Ce geste nécessite une anesthésie générale courte et une hospitalisation durant généralement 24 h à 48 h. Cette prothèse est mise durant l’endoscopie, par voie naturelle. Il n’y a pas de cicatrice. Les complications de ce geste sont assez rares (douleurs par inflammation pancréatique ou fièvre). Le drainage réalisé est rapidement efficace 9 fois sur 10. Cependant, au bout de plusieurs mois, la prothèse peut se boucher du fait de l’accumulation de sédiments de la bile, de la repousse de la tumeur à travers les mailles de la prothèse, ou de son déplacement. Si elle est en plastique, on la retire pour la changer. Par contre, les prothèses métalliques ne s’enlevant pas, on en pose une autre à l’intérieur (plastique ou métallique) pour la désobstruer à l’occasion d’une nouvelle endoscopie.
- Dérivation du canal cholédoque par un geste chirurgical. Ce geste a une efficacité prolongée mais il nécessite une intervention chirurgicale ; si on décide de la faire, un autre geste est souvent réalisé (dérivation digestive préventive, alcoolisation contre les douleurs). Il est de moins en moins réalisé.
Rarement, la jaunisse est due à la présence de métastases dans le foie. Dans ce cas, seul un traitement médical (chimiothérapie) est susceptible d’améliorer les choses. En revanche, un drainage des voies biliaires n’est pas indiqué, car une obstruction du cholédoque n’est pas en cause.
Comment sont traités les vomissements ?
Ils peuvent avoir 3 causes :
- le plus souvent, il existe un obstacle sur le tube digestif,
- il peut s’agir d’un effet secondaire d’une chimiothérapie, ou de la radiothérapie,
- plus rarement, ils sont secondaires à l’administration d’un dérivé de la morphine (au début). L’obstacle digestif peut siéger sur le duodénum car la tête du pancréas est entourée par ce segment d’intestin. Dans ce cas, on peut placer une prothèse dans la sténose (rétrécissement) après l’avoir dilatée, sous contrôle endoscopique ou radiologique comme pour les sténoses biliaires (à ceci près que le calibre de la prothèse – toujours en métal cette fois – est plus important, adapté au diamètre du duodénum).
Un geste chirurgical de dérivation entre l’estomac et l’intestin situé au-delà de la sténose (appelé jéjunum) est une autre solution.
Parfois, l’obstacle est situé plus bas sur l’intestin, ou il existe plusieurs zones d’obstruction et dans ce cas, une dérivation endoscopique ou chirurgicale n’est pas envisageable. Lorsque les vomissements sont importants, rendant l’alimentation impossible, parfois associés à un arrêt du transit, une hospitalisation est nécessaire pour lever l’occlusion. Des traitements médicamenteux (dérivés de la cortisone, principalement) sont administrés. La mise en place d’une sonde pour aspirer le contenu de l’estomac est parfois nécessaire.
Lorsque les vomissements sont dus à la chimiothérapie, le traitement médical anti-vomitif doit être renforcé. Parfois, il existe un effet « réflexe » survenant à la simple idée de la perfusion ou l’entrée dans le service de chimiothérapie (vomissements dits « anticipés » qui surviennent avant même que la chimiothérapie soit administrée) qui peut être réduit par un traitement sédatif ou une technique de relaxation/hypnose.
Les vomissements survenant lors de l’introduction d’un traitement morphinique sont passagers. L’adaptation de la dose et/ou la prise des médicaments anti-vomitifs sont proposées.
Comment sont traités les autres symptômes ?
Un gonflement du ventre peut survenir. Il peut être en rapport avec la présence de liquide dans le sac qui entoure les viscères (appelé péritoine). Le terme médical est celui d’« ascite ». Les mécanismes qui expliquent sa survenue sont complexes (inflammation du péritoine au contact de la tumeur, gêne au retour du sang ou des lymphatiques des membres inférieurs…). Il s’accompagne parfois d’œdème (gonflement) des chevilles et des jambes. Lorsque la quantité de liquide est importante et gênante, les ponctions évacuatrices sont peu douloureuses et très efficaces mais doivent souvent être répétées à intervalles réguliers.
L’amaigrissement et la dénutrition sont fréquents en cas de cancer du pancréas. Les traitements spécifiques (chimiothérapie, radiothérapie) et des apports nutritionnels renforcés peuvent permettre de stabiliser le poids. Dans certains cas, une nutrition artificielle (par perfusion) peut être recommandée si l’alimentation par la bouche est insuffisante (nutrition par sonde nasogastrique ou par injection dans le site implantable).
Une diarrhée peut survenir. Elle peut être due aux traitements ou à une insuffisance de digestion des aliments par défaut partiel de fonctionnement du pancréas. Des extraits pancréatiques (gélules) sont alors proposés et doivent être pris pendant les repas et les collations. Parfois, la diarrhée est liée à une accélération du transit (on l’appelle « motrice »), souvent après une opération du pancréas, et on a recours aux freinateurs du transit (lopéramide…) (cette partie est détaillée dans les questions 15 et 16).
Un diabète peut être présent au diagnostic ou survenir durant l’évolution. Il doit être soigneusement pris en charge car s’il est mal équilibré, un amaigrissement rapide et important peut survenir.
La fatigue a généralement plusieurs causes : elle peut être liée à la tumeur et à la réaction inflammatoire importante qu’elle entraîne, aux douleurs si elles sont insuffisamment calmées ou à l’inverse aux effets des dérivés morphiniques récemment introduits, à l’amaigrissement, à un manque de globules rouges (anémie) ou à une dépression. Une activité physique adaptée régulière est susceptible de diminuer la fatigue générale une fois les causes spécifiques traitées (anémie, etc…).
L’anxiété et la dépression sont fréquentes. Leur prise en charge est détaillée dans la rubrique « Conseils pratiques ».
Auteurs







