Le traitement des cancers de l’estomac et du cardia
Comment se prend la décision thérapeutique ?
Le diagnostic et la prise en charge d’un cancer de l’estomac nécessitent l’intervention de plusieurs médecins :
- le médecin généraliste qui décide d’ordonner des examens en
présence d’un symptôme - le gastro-entérologue qui réalise une endoscopie pour visualiser la
tumeur et réalise des biopsies* - le radiologue qui interprète les images demandées dans le cadre
du bilan initial - l’anatomopathologiste qui lit les biopsies donnant le diagnostic
de certitude et met si besoin en route les examens moléculaires ou
génétiques complémentaires nécessaires en collaboration avec
l’oncogénéticien - le biologiste qui interprète les résultats des prises de sang réalisées sur le patient.
Le chirurgien, le cancérologue (ou oncologue*), le radiothérapeute et/ou le gastro-entérologue formé en cancérologie digestive décident de la meilleure stratégie une fois le diagnostic établi. La prise en charge suppose aussi l’intervention de nombreux autres acteurs : infirmiers, aides-soignants, psychologues, diététiciens, assistants sociaux, etc.
Dans tous les cas, le traitement proposé a été discuté et décidé en réunion de concertation pluridisciplinaire* (RCP) impliquant l’avis de tous les spécialistes concernés et le médecin traitant est informé de la proposition thérapeutique. Le traitement préconisé est bien entendu adapté à chaque cas personnel (extension de la maladie, contexte général, autres maladies existantes…).
La mise en place de ces RCP est une des avancées majeures du 1er « Plan Cancer » instauré en France en 2003. Ces RCP garantissent une décision thérapeutique collégiale (c’est-à-dire prise par plusieurs spécialistes à la fois) et conforme aux référentiels (c’est-à-dire aux règles établies par des spécialistes du cancer et adoptées par la communauté médicale dans son ensemble).
En principe, à la suite de la RCP, le patient bénéficie d’une consultation d’annonce* où lui sont expliquées les décisions prises en RCP ; il lui est demandé son adhésion et son accord. Il lui est recommandé de poser toutes les questions relatives aux détails de son traitement et à sa prise en charge.
A cette occasion, il rencontrera souvent (dans le même temps ou de manière décalée) un infirmier ou autre personne impliquée dans son traitement pour lui donner des explications pratiques nécessaires à sa prise en charge optimale.
Les consultations d’annonce sont une autre avancée du « Plan Cancer » : elles ont été mises en place dans tous les lieux de traitement du cancer, enregistrées auprès des ARS (Agence Régionales de Santé) et sont un complément très utile de la prise en charge des patients.
1. La chirurgie
Quelle est la place de la chirurgie dans le traitement des cancers de l’estomac et du cardia ?
Lors d’une réunion de concertation pluridisciplinaire (RCP), un protocole de traitement est décidé en fonction de l’âge du patient, de son état général et de l’étendue du cancer. Cette décision peut être remise en cause par le médecin référent après application ou prise en compte des souhaits du patient.
Dans ce cas cette remise en cause doit être justifiée. La chirurgie est envisagée à chaque fois qu’elle est possible pour enlever la tumeur et améliorer les symptômes.
Si le cancer peut être opéré et que l’état général permet d’envisager l’intervention, une chirurgie consistant à enlever tout ou une partie de l’estomac est proposée. Cette intervention d’exérèse de l’estomac est le traitement de référence des cancers de l’estomac sans métastase à distance et le principal traitement permettant d’offrir une chance de guérison. L’exérèse du cardia ou de l’estomac (gastrectomie) est associée à une exérèse des ganglions, appelée curage ganglionnaire. Ce curage permet de rechercher la présence ou l’absence d’une extension de la maladie aux ganglions situés autour et à proximité de l’estomac. Il est possible en cas de besoin d’étendre l’exérèse à la rate, au pancréas ou au côlon.
Dans les formes très précoces de cancer, ce seul traitement chirurgical est souvent suffisant mais, la plupart du temps, dans les formes localisées, une chimiothérapie préopératoire est proposée (appelée chimiothérapie néo-adjuvante) car elle permet de réduire le risque ultérieur de récidive* de la maladie et augmente de façon importante les chances de guérison.
Dans les cancers du cardia, en fonction de la localisation il pourra être proposé une chimiothérapie ou une association radio-chimiothérapie. S’il existe une extension à distance du cancer de l’estomac ou du cardia (métastases), la chirurgie n’est alors plus le meilleur traitement : une chimiothérapie ± thérapie ciblée doit être envisagée.
Cependant, en cas d’hémorragie au niveau de la tumeur, on peut alors pratiquer une exérèse dite « palliative » de l’estomac dans le but d’améliorer les symptômes et la qualité de vie. Dans cette situation il est également possible de proposer une radiothérapie* pour juguler l’hémorragie. En cas d’obstruction de l’estomac et si la tumeur ne peut être enlevée en raison d’une extension à des organes situés autour de l’estomac, une intervention dite de dérivation est possible si la tumeur est située sur la partie basse de l’estomac.
Elle consiste à court-circuiter la tumeur en suturant (anastomose gastro-jéjunale) l’intestin grêle sur l’estomac au-dessus de la tumeur. Il est aussi parfois proposé une pose de prothèse rigide si la tumeur est occlusive et non opérable.
Quels sont les différents types d’interventions ?
Il existe plusieurs types d’interventions chirurgicales pour faire l’exérèse d’un cancer de l’estomac. Le choix est principalement fait en fonction de la localisation de la tumeur dans l’estomac.
Si la tumeur est localisée dans la partie moyenne ou haute de l’estomac, seule une intervention visant à enlever la totalité de l’estomac est possible (gastrectomie totale). La continuité digestive est restaurée en suturant l’intestin grêle sur l’œsophage avec une technique un peu particulière dite « anse en Y » pour éviter le reflux de bile vers l’œsophage (figures 1 A et 2).
Si la tumeur est localisée dans la partie la plus proche du pylore (sortie de l’estomac vers le duodénum), une gastrectomie partielle (appelée aussi des 4/5) consistant à conserver uniquement la partie supérieure de celui-ci est faite, puis l’intestin grêle est suturé à l’estomac restant (figures 1 B et 3).
Si la tumeur de l’estomac est située sur le cardia ou sur la jonction avec l’œsophage, il y a deux possibilités de traitement en fonction de l’importance de l’atteinte de ce dernier :
- si l’atteinte de l’œsophage est peu importante, il est possible de faire une gastrectomie totale associée à une œsophagectomie partielle (exérèse de la partie inférieure de l’œsophage) et un rétablissement de la continuité par suture entre l’œsophage et l’intestin grêle sectionné en « Y ». Une ouverture du thorax gauche est alors souvent nécessaire afin d’accéder à l’oesophage.
- si la tumeur remonte sur l’œsophage, cette dernière technique
n’est plus possible. On conserve alors une partie de l’estomac pour en faire un tube et on le suture sur la partie haute de l’œsophage au prix d’une cicatrice supplémentaire au niveau du thorax droit ou au niveau du cou (figure 4).
Dans tous ces cas, le chirurgien réalise une exérèse des ganglions (curage ganglionnaire) situés à proximité de l’estomac.
L’ensemble (estomac et ganglions) est adressé au laboratoire d’anatomopathologie pour préciser le degré d’extension du cancer dans la paroi de l’estomac et dans les ganglions.
Si la gastrectomie n’est pas possible en raison de l’extension du cancer, la tumeur est laissée en place et une dérivation entre l’estomac et l’intestin grêle est parfois réalisée (figure 5). Mais de manière générale, lorsque la chirurgie ne permet pas de retirer l’ensemble de la tumeur (ou lorsqu’il y a des métastases), il est préférable de ne pas opérer pour permettre plus rapidement la mise en route du traitement médical.
Quelle est la place de la cœlioscopie ou laparoscopie dans la prise en charge des cancers de l’estomac ou du cardia ?
Bien que la chirurgie reste le traitement de référence permettant d’offrir aux patients opérés à un stade précoce une survie prolongée ou un espoir de guérison, plus de deux tiers des cancers gastriques sont diagnostiqués aux stades avancés. Tous les examens préopératoires, même les plus modernes, sont décevants pour la détection de l’extension de la tumeur (métastases) notamment vers le foie ou le péritoine (tissu qui recouvre les organes à l’intérieur de la cavité abdominale). Lors de l’intervention, la possibilité de découvrir des métastases, non identifiées lors du bilan préopératoire, est de 25 à 40 %.
La cœlioscopie (laparoscopie) permet de visualiser l’extension de la tumeur au-delà de l’estomac (ganglions, foie, péritoine), avec une précision encore non atteinte par les techniques d’imagerie, et de réaliser des prélèvements (biopsies). Elle peut donc être réalisée au moment du bilan d’extension de la maladie, avant une chimiothérapie si une chirurgie n’est pas envisagée dans un premier temps.
Les dérivations digestives sont possibles par laparoscopie. Le retrait de la tumeur de l’estomac ou du cardia est également réalisable par laparoscopie mais cette technique n’est pas encore courante.
Comment se déroule l’intervention ?
Après la consultation avec le chirurgien, le patient doit rencontrer l’anesthésiste et effectuer tous les examens requis pouvant évaluer son état général ainsi que l’extension de sa maladie.
Avant l’intervention : une fois l’intervention programmée, le patient entre dans le service de chirurgie le plus souvent la veille de l’intervention. Le jeûne commence à minuit pour une intervention programmée le lendemain. Si la tumeur gêne l’évacuation de l’estomac, il sera effectué la veille de l’intervention une aspiration du contenu de l’estomac à l’aide d’une sonde naso-gastrique (petit tuyau introduit temporairement par une narine et descendant jusqu’à l’intérieur de l’estomac) pour réduire les risques de complications au cours de l’anesthésie.
Pendant l’intervention : l’intervention débute par une exploration de l’abdomen pour évaluer l’extension au foie, au péritoine, aux ganglions et aux organes proches de l’estomac. Il est possible au cours de l’intervention de réaliser des prélèvements pour analyse au microscope. Lorsque l’ablation de la tumeur a été effectuée, l’ensemble (estomac et ganglions situés autour de celui-ci) est adressé en anatomopathologie pour une étude approfondie. La continuité digestive est assurée de différentes manières avant de refermer la paroi abdominale.
Après l’intervention : pendant les premiers jours postopératoires, il
est interdit au patient de s’alimenter. S’il a une sonde naso-gastrique, principalement après gastrectomie partielle, celle-ci sera enlevée sur décision du chirurgien. De la même façon, c’est le chirurgien qui décidera de la reprise de l’alimentation. Après gastrectomie totale, on peut demander au patient opéré de boire du liquide opaque en radiologie pour vérifier l’étanchéité de la suture. La réintroduction de l’alimentation est en général autorisée vers le 5e jour après une gastrectomie partielle et vers le 7e jour après une gastrectomie totale.
La perfusion est retirée une fois que les apports hydriques et/ou caloriques sont suffisants. Un drainage de la cavité abdominale est parfois nécessaire ; il sera retiré dès que le chirurgien note que l’évolution est favorable, notamment par l’absence de fièvre et la reprise du transit intestinal (gaz et selles). La réalimentation est progressive.
Quels sont les risques de l’intervention ?
La chirurgie des cancers de l’estomac reste une chirurgie lourde, des complications postopératoires peuvent survenir. Il s’agit soit de complications générales qui peuvent se manifester dans toutes les chirurgies importantes, soit de complications spécifiques de la chirurgie de l’estomac. La mortalité généralement inférieure à 3 % est d’autant plus faible que le centre est spécialisé dans la chirurgie lourde et dans celle des cancers digestifs.
Les complications spécifiques sont les hémorragies dans la cavité abdominale ou dans le tube digestif, par saignement au niveau de la ligne de suture ou défaut de cicatrisation des sutures faites sur les organes digestifs. Il peut alors se produire de la fièvre postopératoire et parfois un abcès ou un écoulement de liquide digestif par le drain. Une nouvelle intervention est parfois nécessaire.
Ces complications sont sources d’une prolongation de la période de jeûne et d’une prolongation de la durée d’hospitalisation. Pendant cette période, la lutte contre la dénutrition doit être au premier plan.
Comme pour toute intervention chirurgicale, d’autres complications générales sont possibles.
Quelles sont les précautions à prendre après l’intervention et lors du retour au domicile ?
La fonction principale de l’estomac est celle d’un réservoir capable de s’adapter au volume du repas puis de le déverser lentement vers l’intestin grêle.
Les règles hygiéno-diététiques sont fondamentales pour atténuer les manifestations digestives après gastrectomie. Celles-ci sont surtout importantes pendant les trois premiers mois et s’atténuent ou disparaissent par la suite.
En pratique, le patient peut manger normalement, mais en quantité plus réduite.
La règle diététique principale est la fragmentation des repas. Cela consiste à réduire le volume des repas qui sont alors entrecoupés de collations pour maintenir la même quantité de calories absorbées chaque jour. Les repas doivent être pris dans le calme et lentement
pour prendre le temps de bien mâcher.
Si le patient ressent des symptômes (voir question « Quels sont les symptômes des cancers de l’estomac et du cardia ? »), il faut bien adapter le volume des repas, éviter les sucres rapides, augmenter les graisses, éviter les aliments liquides, éviter les boissons gazeuses et ne pas boire pendant les repas.
En cas de perte d’appétit, ce qui est fréquent après gastrectomie, et lorsque l’amaigrissement est important, il est possible d’augmenter la quantité journalière de calories soit par une perfusion intraveineuse, soit par une mini-sonde poussée jusque dans l’estomac résiduel ou l’intestin grêle, ou par des compléments hypercaloriques pris par la bouche.
Avant de rentrer à son domicile, le patient doit pouvoir s’alimenter
suffisamment et avoir eu une consultation diététique. Les règles diététiques doivent pouvoir être poursuivies lors du retour à domicile. Si les conditions personnelles du patient ne lui permettent pas de respecter ces objectifs, une maison de convalescence spécialisée dans les maladies digestives est alors utile pour prendre le relais de l’hôpital pendant quelques semaines.
La surveillance du poids est fondamentale. L’amaigrissement est quasi constant après gastrectomie pour cancer. Si tout se passe bien, le patient reprendra progressivement du poids mais se stabilisera souvent à un poids inférieur à celui qu’il avait avant l’intervention.
En cas de retard à la reprise de poids ou bien si l’amaigrissement continue, des compléments nutritionnels hypercaloriques seront prescrits. Après quelques mois, le patient ressentira de lui-même la possibilité d’augmenter le volume de ses repas et donc pourra diminuer leur fréquence.
Quelles sont les conséquences à moyen et long terme de l’intervention ?
L’absence d’une partie ou de tout l’estomac entraîne des modifications sur la digestion pouvant s’exprimer par différents symptômes.
Le « syndrome de petit estomac » est la sensation d’avoir l’estomac plein après un repas moins copieux qu’auparavant. Le traitement repose sur la prise de repas moins copieux mais plus fréquents.
La sensation de satiété apparaîtra d’autant plus volontiers que le volume résiduel de l’estomac est petit.
Le « dumping syndrome » est dû à l’arrivée trop rapide des aliments
dans l’intestin grêle et est favorisé par la prise d’aliments riches en sucres. Il se manifeste rapidement après les repas par une sensation de malaise général avec fatigue brutale, bouffées de chaleur, sueurs, palpitations, tachycardie, pâleur, douleurs abdominales, diarrhées, nausées, perte d’appétit, et somnolence. La fréquence et l’importance de ces différents symptômes sont très variables. C’est l’association de plusieurs de ces manifestations et leur répétition qui doivent évoquer le « dumping syndrome ». Ces symptômes sont améliorés par la position allongée et le respect des règles diététiques en particulier en supprimant ou limitant la prise de sucre et d’aliments sucrés.
En effet, après une prise trop importante de sucres à absorption rapide, il peut se produire un pic d’hyperglycémie suivi d’une hypoglycémie réactionnelle à une sécrétion excessive d’insuline entraînant un malaise avec somnolence, survenant environ 1 à 3 heures après la prise du repas.
Une diarrhée, principalement due à la section de certains nerfs qui entourent l’estomac, est habituelle en période postopératoire. Elle se manifeste par des selles liquides et abondantes, notamment le matin après le repas. La diarrhée régresse en général en quelques mois mais elle peut persister dans certains cas.
D’autres symptômes sont possibles : perte de poids, malnutrition, carence en fer, reflux alimentaire vers l’œsophage et vomissements
de bile le matin.
À plus long terme, après gastrectomie totale, il se produit une carence en vitamine B12 responsable d’une anémie qui, si elle n’est pas corrigée peut être à l’origine de manifestations neurologiques. La prise orale de vitamine B12 n’est d’aucune utilité car elle n’est plus absorbée. La prévention repose sur l’administration intramusculaire de vitamine B12 tous les 2 à 6 mois.
2. La chimiothérapie
Qu’est-ce que la chimiothérapie ?
La chimiothérapie est un traitement utilisant des médicaments anticancéreux.
Ces médicaments ont pour but de détruire les cellules cancéreuses ou d’empêcher leur prolifération, ils sont dits cytotoxiques. Les cellules cancéreuses sont des cellules anormales qui se divisent rapidement et engendrent d’autres cellules anormales sans contrôle.
Il existe plusieurs types de médicaments anticancéreux qui interfèrent avec le développement des cellules, soit pendant leur multiplication (les traitements sont appelés antimitotiques, la mitose signifiant la division de la cellule avec naissance de deux cellules filles), soit pendant la phase de fabrication de l’ADN. Ces médicaments peuvent aussi affecter les cellules saines, d’où la possible baisse des globules blancs, des globules rouges et des plaquettes, et les possibles autres toxicités ou effets secondaires observés pendant la chimiothérapie.
Un point important est de dédramatiser le terme de chimiothérapie.
Il s’agit d’un traitement comme un autre mais avec des médicaments ayant une activité et une toxicité propre.
Une autre idée importante est de ne pas craindre de communiquer avec l’équipe soignante.
Le patient doit se sentir libre de poser au médecin ou à l’infirmier toutes les questions qu’il souhaite. Il est parfois utile d’en faire une liste avant le rendez-vous pour ne rien oublier.
Quels sont les différents types de chimiothérapies ?
Les chimiothérapies sont généralement des poly-chimiothérapies, ce qui veut dire qu’elles associent plusieurs médicaments. L’intérêt d’associer deux ou trois médicaments entre eux est que chacun agit à différents moments du développement des cellules cancéreuses (par exemple, l’un agit sur les phénomènes de division proprement dits, l’autre sur la fabrication de l’ADN). Ainsi, les associations sont souvent plus efficaces qu’un seul médicament.
Ces associations de médicaments (aussi appelées « protocoles ») sont généralement identifiées par les initiales des produits de chimiothérapie qui les composent. Par exemple, le protocole « FOLFOX » est une association de 5-fluorouracile et d’oxaliplatine ; le « FOLFIRI » est une association de 5-fluorouracile et d’irinotécan ; le « FLOT ou TFOX » associe en plus du 5-fluorouracile et de l’ oxaliplatine, une taxane appelée docetaxel.
À chaque fois qu’une nouvelle molécule de chimiothérapie est découverte, elle est testée pour son efficacité sur chaque type de cancer, d’abord sur des cultures de cellules tumorales, puis chez l’animal avant d’être utilisée chez l’homme. De nombreuses molécules de chimiothérapie sont efficaces contre les cancers de l’estomac : les
fluoropyrimidines (5-fluorouracile, capécitabine), les sels de platine
(cisplatine, oxaliplatine), le CPT-11 (irinotécan), les taxanes (docetaxel,
paclitaxel)…
Des associations de ces médicaments entre eux sont réalisées afin d’obtenir la meilleure efficacité et la meilleure tolérance
possibles. Ainsi, si un protocole d’association n’est pas efficace contre
le cancer ou montre ses limites après avoir été efficace, une autre association peut être proposée à l’aide de médicaments qui n’ont pas
été administrés en première ligne. La trifluridine/tipiracil associe 2 principes actifs médicamenteux, la trifluridine, un antinéoplasique (analogue nucléosidique de la thymidine) et le tipiracil, un inhibiteur de la thymidine phosphorylase qui freine la dégradation de la trifluridine et qui s’administre par voie orale.
Cette chimiothérapie a récemment démontrée son efficacité après au moins deux lignes de traitement préalables et a obtenu une Autorisation de mise sur le marché (AMM) en monothérapie.
Le médecin propose donc un protocole de chimiothérapie composé
des médicaments qu’il jugera les plus adaptés à chaque patient, en
fonction de l’état actuel des connaissances scientifiques et de ses
éventuelles contre-indications à tel ou tel médicament. Il peut également proposer au patient de participer à une étude clinique. Les modalités d’administration des traitements (durée, fréquence) varient alors selon les protocoles.
Dans quels cas la chimiothérapie est-elle conseillée ou nécessaire ?
La chimiothérapie peut être proposée dans trois situations en cas de cancer de l’estomac ou du cardia.
Pour les formes localisées de tumeur gastrique ou du cardia, le traitement repose le plus souvent sur de la chimiothérapie péri-opératoire, c’est-à-dire avant (pré-opératoire) et après (postopératoire) la chirurgie d’exérèse. Elle peut également faciliter la chirurgie, en particulier en cas de grosse tumeur difficilement extirpable, en la faisant diminuer de taille. Son utilisation avant l’ablation de la tumeur peut aussi permettre de mieux déterminer les traitements les plus efficaces.
Dans le cas des tumeurs du cardia cela peut également être dans certains cas, une association de radiothérapie et de chimiothérapie.
La chimiothérapie postopératoire (nommée également« adjuvante ») est une chimiothérapie réalisée après l’acte chirurgical. Son but est de détruire d’éventuelles cellules tumorales résiduelles, non visualisées lors de l’intervention et ainsi de diminuer le risque de rechute.
La chimiothérapie postopératoire peut être associée à la radiothérapie (et s’appelle alors une « chimio-radiothérapie ») dans certaines situations discutées en RCP. Ces traitements complémentaires de chimiothérapie et radiothérapie ont montré qu’ils permettaient une amélioration de la survie des patients par rapport à la chirurgie seule.
La chimiothérapie palliative est une chimiothérapie administrée lorsqu’il n’y a pas de possibilité de chirurgie, le plus souvent en cas de présence de métastases ou de rechute. L’objectif du traitement est alors de prolonger la vie des patients et d’améliorer leur confort et donc leur qualité de vie.
La chimiothérapie est dite de « première ligne » lorsqu’elle est administrée chez des malades n’ayant jamais reçu de chimiothérapie. Elle est dite de « deuxième ligne » lorsqu’elle est administrée à la suite d’une chimiothérapie de première ligne qui a été inefficace ou dont l’efficacité n’a été que temporaire. On peut ainsi être amené à proposer plusieurs lignes de chimiothérapie en fonction de l’évolution de la maladie.
Combien de temps dure le traitement médical ?
La chimiothérapie est administrée sous forme de cycles ou cures. Chaque cycle consiste en un ou plusieurs jours de traitement selon le protocole, suivis d’une période de repos pendant laquelle les cellules normales peuvent se régénérer. Puis le cycle est répété.
Le médecin choisit le meilleur protocole pour chaque cas personnel. Ce protocole est basé sur un certain nombre de facteurs, tels que le stade du cancer, les médicaments les plus efficaces et les moins toxiques pour chaque situation, les autres traitements reçus antérieurement ou pendant la chimiothérapie, etc. Il est très important de respecter aussi strictement que possible le protocole de traitement. C’est la condition indispensable pour optimiser le résultat.
Les chimiothérapies pré- et post-opératoires ont une durée limitée dans le temps (en général pendant 2-3 mois avant et 2-3 mois après la chirurgie, mais peuvent parfois être prolongées si le médecin et le chirurgien le jugent nécessaire).
La durée des chimiothérapies palliatives ne peut être prévue à l’avance : le traitement doit être administré aussi longtemps qu’il est efficace (des évaluations régulières sont prévues) et on est souvent amené à pratiquer des modifications de chimiothérapie au cours de l’évolution de la maladie. Il est cependant possible dans certains cas de ménager des pauses dans le traitement de chimiothérapie palliative.
Comment se passe la chimiothérapie ?
Pour traiter les cancers de l’estomac ou du cardia, la chimiothérapie est le plus souvent administrée par voie injectable, parfois par voie orale (sous forme de comprimés). Les médicaments de chimiothérapie sont diffusés dans tout le corps au travers du sang.
Les perfusions des différents médicaments sont réalisées généralement les unes après les autres. Chaque produit a un mode d’administration qui lui est propre (par exemple, le 5-fluorouracile en perfusion continue pendant 48 heures, le docetaxel (taxotère) en perfusion d’une heure, l’oxaliplatine en perfusion de 2 heures…). On utilise le plus souvent un cathéter implanté pour la réalisation des perfusions.
Les traitements sont administrés de façon standardisée, d’où le nom de protocole. Celui-ci est écrit et signé par le médecin puis mis en place par l’infirmière. Les doses des médicaments anticancéreux sont adaptées au poids et à la taille de chaque patient. Elles doivent donc être diminuées en cas d’amaigrissement.
Ces protocoles respectent des indications et des contre-indications spécifiques. Les patients sont vus régulièrement avant chaque cure avec une prise de sang pour vérifier que le nombre de globules blancs et de plaquettes autorise la réalisation de la cure et pour adapter si besoin le traitement en cas de problème de toxicité.
Des bilans sont également effectués à intervalle régulier (en général tous les 2 à 3 mois) pour vérifier l’efficacité du traitement. Le médecin s’aidera pour cela d’examens d’imagerie (par exemple un scanner, des radiographies ou une échographie) et d’examens biologiques, tels que des marqueurs tumoraux sanguins.
Qu’est-ce qu’une chambre implantable, une pompe portable de chimiothérapie ?
La perfusion de chimiothérapie et de la plupart des thérapies ciblées et des anticorps monoclonaux nécessite la pose d’un dispositif interne (la chambre implantable) relié à une grosse veine centrale par un cathéter, permettant de perfuser de façon prolongée ou d’administrer les traitements intraveineux en toute sécurité. Elle évite l’effet toxique du produit sur des veines de calibre inférieur, comme celles du bras. Elle est particulièrement indiquée lorsque les veines sont fragiles ou inutilisables.
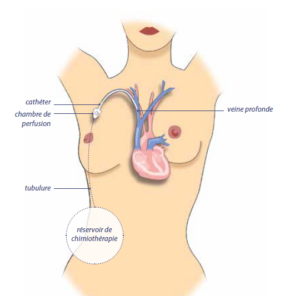
La perfusion de chimiothérapie nécessite également un dispositif externe (poche de perfusion, pompe, pousse seringue, diffuseur) pour stocker et distribuer le produit via une tubulure jusqu’à la chambre implantable.
La chambre implantable (ou cathéter implantable ou port à cath ou
PAC) se compose d’une chambre, sorte de petit réservoir surmonté
d’un septum (membrane épaisse) et d’un cathéter, fin tuyau qui se fixe à la chambre. Le cathéter est posé sous anesthésie locale dans la plupart des cas. La pose de la chambre nécessite une incision de quelques centimètres sur la paroi thoracique entre la clavicule et le sein. Si besoin, elle peut se faire sous anesthésie générale. Le cathéter est glissé sous la peau, de la chambre jusqu’à son entrée dans la veine, au niveau du cou le plus souvent, ou en dessous de la clavicule.
L’extrémité du cathéter est introduite dans la grosse veine s’abouchant au cœur, appelée veine cave supérieure. Lors des perfusions, l’infirmière utilise une aiguille spéciale (aiguille de Huber) qui traverse la peau pour se planter dans le septum du réservoir, ce qui est pratiquement indolore et beaucoup plus confortable que la perfusion dans le bras. L’application d’un pansement anesthésique (patch Emla®) permet d’éviter d’éventuelles douleurs locales.
Les avantages de la chambre implantable sont supérieurs à ses inconvénients : elle permet des perfusions continues, les injections
sont moins douloureuses et le risque d’extravasation (fuite de produit sous la peau) est très réduit. En cas de perfusion continue, le cathéter est relié à une pompe portable, en général à usage unique et de faible volume, permettant de vivre presque normalement. Bains et douches sont possibles en dehors du traitement car la chambre est bien protégée par la peau.
Une hospitalisation est-elle nécessaire pour recevoir une chimiothérapie ?
La plupart des traitements utilisés dans les cancers de l’estomac peuvent être suivis en hôpital de jour ou centre de chimiothérapie dite ambulatoire, c’est-à-dire sans passer la nuit à l’hôpital.
Les lits et fauteuils de chimiothérapie ambulatoire permettent d’administrer un traitement qui va débuter dans un cadre hospitalier où le patient est surveillé par une infirmière spécialisée.
Puis, en fonction du protocole choisi, le traitement pourra se poursuivre à la maison grâce à un infuseur, sorte de petit réservoir portatif, de la taille d’un biberon qui administre automatiquement la chimiothérapie (c’est le cas par exemple des protocoles FOLFOX, FOLFIRI, FLOT ou TFOX).
Quelquefois, les traitements nécessitent une courte hospitalisation
de 24 ou 48 heures si le médicament nécessite par exemple une perfusion longue d’hyperhydratation en milieu hospitalier (cela peut être le cas du cisplatine afin de prévenir une toxicité rénale de la chimiothérapie) ou lorsque les effets secondaires des médicaments doivent être surveillés de près.
Quels sont les effets secondaires de la chimiothérapie ?
Comme tous les médicaments, les chimiothérapies peuvent provoquer des effets secondaires. Leur survenue n’est pas systématique mais elle est fréquente. Leur intensité ou leur gravité est très variable d’un sujet à l’autre. On dispose maintenant de nombreux médicaments qui permettent d’atténuer voire d’empêcher certains effets secondaires. Le médecin les prescrit en fonction du risque du protocole et les adapte en fonction de
chaque tolérance individuelle.
Il est difficile de résumer les effets secondaires des chimiothérapies
utilisées dans les cancers de l’estomac car ils dépendent évidemment du protocole utilisé. Il est de la responsabilité du médecin cancérologue d’informer sur les effets secondaires provoqués par le protocole administré.
Pendant toute chimiothérapie, il existe un risque temporaire de baisse des globules blancs (risque d’infection) et des plaquettes (risque d’hémorragie). Une prise de sang avant chaque cycle est nécessaire afin de juger si la cure peut être réalisée ou non. Si les globules ou les plaquettes sont trop bas, le médecin peut décider de retarder le traitement et/ou d’en diminuer les doses.
Sans être complète, voici une liste d’effets secondaires que l’on peut observer avec les principaux médicaments de chimiothérapie utilisés dans les cancers de l’estomac :
- Fluoropyrimides (5-fluorouracile : administré par voie intraveineuse, ou capécitabine : comprimés à prendre oralement) : diarrhée, aphtes dans la bouche, modification de la peau des mains et des pieds, et très rarement douleurs thoraciques d’origine cardiaque imposant l’arrêt immédiat du traitement. Les modifications de la peau des mains et des pieds sont plus fréquentes et en général plus sévères avec les formes orales de 5-fluorouracile (capécitabine) ;
- taxanes (docetaxel ou paclitaxel) : alopécie (perte de cheveux)
fréquente, modification des ongles, neuropathie (atteinte des nerfs sensitifs), gonflement des jambes justifiant une prémédication par corticoïdes ; - cisplatine : insuffisance rénale (ce risque impose une hydratation
importante par perfusion, le plus souvent administrée avant et
après l’administration de cisplatine, ce qui justifie souvent son
administration en hospitalisation), nausées et vomissements, perte d’appétit et/ou modification du goût des aliments, diminution de l’audition et neuropathie ; - oxaliplatine : bien qu’étant de la même famille que le cisplatine,
l’oxaliplatine n’entraîne pas d’insuffisance rénale et est bien mieux toléré en termes de nausées que le cisplatine. L’oxaliplatine induit très fréquemment une neuropathie, avec fourmillements au niveau des extrémités, peu gênante au début (souvent liée au froid) mais cumulative (c’est-à-dire que cette neuropathie augmente au fur et à mesure des cycles). Elle est cependant réversible et un stade sévère de neuropathie peut être prévenu par l’interruption du produit. Ce produit peut également entrainer de rares réactions allergiques ; - irinotécan : alopécie possible dans 15% des cas, nausées, diarrhées
parfois sévères et pouvant être traitées avec succès si rapidement
prises en charge ; - trifluridine, tipiracil (comprimé administré par voie orale) : il s’agit d’un médicament qui a démontré récemment son efficacité dans le traitement des formes métastatiques de cancer de l’estomac ou du cardia chez les patients ayant reçu au moins deux lignes de chimiothérapie antérieures. Les principaux effets secondaires de ce médicament sont la fatigue, les troubles digestifs et hématologiques (sur les globules blancs).
Certains effets secondaires comme la perte de cheveux (qui est toujours temporaire) sont très redoutés par les patients, mais ne mettent pas la vie en danger. D’autres (moins connus et donc moins redoutés par les patients) sont potentiellement plus graves et doivent être expliqués par le médecin et connus du patient.
Voici quelques recommandations indispensables :
- En cas de fièvre supérieure à 38,5 °C au cours ou au décours de la
chimiothérapie, ou en cas de saignement, il faut impérativement
pratiquer une prise de sang en urgence et prévenir votre médecin
traitant. Si cette prise de sang montre une baisse importante des globules blancs et/ou des plaquettes, il faut contacter immédiatement son médecin du centre de traitement qui pourra
décider d’une hospitalisation en urgence pour administrer des
antibiotiques par voie veineuse (en cas de baisse des globules blancs) ou exceptionnellement une transfusion de plaquettes (en cas d’hémorragie) et envisager des adaptations de doses et traitement préventifs adaptés pour les cycles suivants. - En cas de vomissements importants et/ou d’impossibilité pour
s’alimenter et surtout pour boire, il faut également contacter votre médecin traitant pour qu’il puisse vous traiter et juger de la nécessité de contacter votre centre de traitement afin d’organiser
une hospitalisation pour vous réhydrater, généralement par des
perfusions. Ceci est particulièrement vrai après une chirurgie de
l’estomac, qui aggrave le risque de vomissements, de mauvaise
alimentation, de déshydratation. - En cas de douleurs dans la poitrine pendant un traitement par 5-fluorouracile ou capecitabine, il faut immédiatement le signaler
pour que soit arrêté le système de perfusion ou arrêter les comprimés de capécitabine. Il faut aller aux urgences de l’hôpital
le plus proche pour pratiquer un électrocardiogramme.
Les effets secondaires de la chimiothérapie ne sont pas systématiques, mais il ne faut pas les négliger. Les conseils donnés dans ce chapitre ne doivent pas dispenser le patient d’une information complète qui lui sera donnée par l’équipe soignante et sera adaptée au type de chimiothérapie qui lui est prescrite. Le patient doit discuter avec l’équipe soignante en cas de symptômes jugés inhabituels et bien décrire les effets secondaires subis : ceci permettra d’adapter les médicaments prescrits pour éviter ou atténuer les effets secondaires.
Dans tous les cas le patient doit avoir sur lui les coordonnées de son centre de traitement et les numéros de téléphone à appeler en cas de problème, en semaine et les nuits, week-ends et jours fériés.
3. La radiothérapie
Qu’est ce que la radiothérapie et la chimio-radiothérapie ?
La radiothérapie est un traitement médical qui consiste à administrer
des rayons (on appelle cela un rayonnement ionisant) sur une région donnée du corps. Il s’agit le plus souvent d’un faisceau de rayons X (photons*) produits par une machine appelée accélérateur de particules. Ce rayonnement va entraîner des lésions de l’ADN* au niveau des cellules tumorales visées et entraîner leur destruction.
La chimio-radiothérapie est un traitement médical antitumoral qui consiste à associer une chimiothérapie à la radiothérapie précédemment décrite, les deux traitements étant administrés en même temps (chimiothérapie concomitante).
Le fait d’associer la chimiothérapie à la radiothérapie permet souvent une meilleure efficacité que la radiothérapie seule car la chimiothérapie va rendre les cellules tumorales encore plus vulnérables aux rayons. La chimiothérapie est donnée à des doses moins fortes lorsqu’elle est associée à une radiothérapie.
Dans quels cas administre-t-on de la radiothérapie, avec ou sans chimiothérapie ?
La radiothérapie pour traiter un cancer de l’estomac peut être envisagée par l’équipe médicale dans plusieurs situations qu’il est important de distinguer :
- la radiothérapie avant une intervention chirurgicale uniquement pour les tumeurs du cardia ;
- la radiothérapie après une intervention chirurgicale ;
- – la radiothérapie sans chirurgie envisagée : si la tumeur n’est pas
résécable (c’est-à-dire que l’on ne peut l’enlever par chirurgie) ou s’il existe des localisations secondaires (métastases), l’équipe
médicale peut proposer une irradiation de la tumeur afin de réduire sa taille, de supprimer les symptômes et, dans certains cas, pour essayer de la stériliser complètement. Ce traitement peut permettre de soulager des douleurs, d’éviter ou de traiter un
saignement au niveau de l’estomac. Ce traitement est en général
associé à un traitement par chimiothérapie. Dans certains cas, s’il
existe une bonne réponse à la chimio-radiothérapie, un traitement par chirurgie peut être ensuite envisagé.
La radiothérapie peut également être utile dans d’autres situations :
- en cas de métastases osseuses (localisation secondaire du cancer
de l’estomac au niveau d’un os), la radiothérapie peut être réalisée
afin de lutter contre la douleur liée à ces métastases ; - en cas de saignement tumoral important, la radiothérapie permet le plus souvent de diminuer rapidement , voire d’arrêter l’hémorragie ;
- en cas de métastase cérébrale, une irradiation cérébrale spécifique
peut également être envisagée.
Pourquoi donner un traitement par chimio-radiothérapie avant une opération chirurgicale ?
L’utilisation d’une chimio-radiothérapie n’est pas systématique. Elle a surtout été validée dans les tumeurs de la jonction entre l’œsophage et l’estomac (le cardia) où elle est considérée comme une alternative à la chimiothérapie péri-opératoire. Des études ont montré que ce traitement avant l’intervention chirurgicale en cas de tumeur du cardia permettait de meilleurs résultats que la chirurgie seule sur le cancer à long terme.
Pourquoi réaliser une chimio-radiothérapie après l’intervention chirurgicale ?
Parfois le traitement par chimiothérapie ou chimio-radiothérapie n’a pas été possible avant l’intervention chirurgicale et la discussion de l’intérêt du traitement se fait en post-opératoire.
La chimio-radiothérapie après l’intervention chirurgicale permet :
- de compléter le traitement du cancer si la tumeur n’a pas pu
être retirée dans sa totalité. C’est le cas si le chirurgien n’a pas pu
réaliser l’exérèse complète et laisse en place un résidu tumoral.
Parfois le chirurgien pense avoir retiré la totalité de la tumeur, mais à l’examen au laboratoire le médecin anatomopathologiste (qui étudie les pièces de résection) met en évidence la persistance de cellules cancéreuses au niveau des limites de résection. Dans ces deux situations, la chimio-radiothérapie aide à stériliser les lésions tumorales encore présentes dans l’organisme. - de traiter la maladie microscopique cancéreuse pour éviter les
récidives et les métastases dans le cas où l’exérèse a été complète.
Cela permet également d’essayer d’éviter les récidives lorsque des ganglions autour de la tumeur prélevés par le chirurgien au cours de l’intervention, sont atteints ou sont insuffisants en nombre pour une analyse anatomopathologique optimale. L’irradiation se fait dans le volume de l’organe qui a été retiré. S’il existe des cellules tumorales résiduelles en dehors de ce volume, la chimiothérapie postopératoire (ou adjuvante*) aura pour but de détruire ces cellules tumorales résiduelles. C’est pourquoi le traitement post-opératoire débute généralement par une chimiothérapie suivie d’une chimio-radiothérapie afin de réduire au maximum le risque de récidive dans les formes les plus à risque de récidives locales et à distance.
Comment l’oncologue radiothérapeute peut-il savoir ce qu’il faut irradier après une gastrectomie ?
Après une gastrectomie ou oeso-gastrectomie, l’oncologue radiothérapeute ne peut irradier l’estomac qui n’existe plus : il va donc repérer sur un scanner de préparation de la radiothérapie (scanner de centrage ou de simulation) la loge de gastrectomie ou oeso-gastrectomie (c’est-à-dire la zone postopératoire où était antérieurement l’estomac) où des cellules tumorales sont susceptibles de persister (maladie microscopique). Pour cela, il va s’aider de l’imagerie réalisée avant l’opération (scanner ou TEP* FDG) qui sera fusionnée avec le scanner de centrage.
Au cours de la chirurgie, le chirurgien peut mettre en place des clips (sorte de petits repères métalliques visibles sur des radiographies et sur le scanner) au niveau des zones à irradier afin de faciliter le repérage de la surface à irradier devenue précisément définie.
Quelles sont les modalités techniques de la radiothérapie ?
Avant de réaliser la radiothérapie, plusieurs étapes sont indispensables :
- la consultation avec un oncologue radiothérapeute : celui-ci pose ou confirme l’indication de radiothérapie et explique le principe du traitement, ce qu’on en attend et ses possibles effets secondaires ;
- la réalisation d’un scanner de simulation afin de délimiter la zone
tumorale à irradier. Le scanner est réalisé dans une position donnée qui devra toujours être la même ensuite, pendant la radiothérapie. Dans le même temps, des repères sont placés au niveau de la peau (points de tatouage ou traits au stylo-feutre). Cette étape s’appelle le centrage. Pour les tumeurs du cardia qui sont mobiles avec la respiration, un scanner 4D (en 4 dimensions, qui prend en compte le temps) est le plus souvent réalisé. C’est un scanner un peu plus long qui, grâce à un boitier placé sur la poitrine, permet d’évaluer l’amplitude des mouvements de la tumeur liés à la respiration et ainsi de définir des marges sur mesure pour chaque patient. Ainsi, la tumeur traitée sera toujours dans les faisceaux d’irradiation tout au long du traitement. Pour certaines tumeurs du cardia, afin d’améliorer la précision du ciblage de la tumeur, des grains d’or visibles au scanner ou à la radio sont mis en place dans le bas de l’œsophage lors d’une écho endoscopie faite avant le centrage. Il ne sera pas nécessaire de les enlever ensuite ; - la dosimétrie est ensuite réalisée : il s’agit de calculs et de simulations sur ordinateur qui permettent de répartir la dose de rayons afin d’irradier au mieux la tumeur et de diminuer au maximum l’irradiation des zones saines. Ces données, une fois validées par le radiophysicien et l’oncologue radiothérapeute, sont transférées à la machine de traitement ;
- réalisation d’une séance « à blanc » : installation du patient sous la machine de traitement avec vérification du bon positionnement
du patient grâce aux repères et à une imagerie, mais sans traitement réalisé à ce stade ;
Après ces étapes préalables, le traitement proprement dit peut débuter : installation du patient sous la machine et réalisation du traitement qui est indolore. La bonne position du patient est vérifiée à chaque séance de traitement au cours de l’installation et au moins 1 fois par semaine par une imagerie réalisée sur la machine.
Les séances de radiothérapie ont lieu en général 1 fois par jour, 5 jours sur 7, pendant 2 à 5 semaines selon l’indication. Les séances n’excèdent pas 10 minutes. Ainsi, avec le temps d’installation et d’attente dans le service, le patient passe environ 30 minutes dans le service par jour.
Pour les tumeurs du cardia parfois très mobiles, un asservissement
respiratoire peut être utilisé : le traitement ne sera réalisé que dans
certaines phases de la respiration, en inspiration par exemple, afin de diminuer le mouvement de la tumeur lié à la respiration.
Ces séances sont réalisées par des techniciens en radiothérapie, appelés manipulateurs en électroradiologie. À chaque séance, les manipulateurs installent le patient sur la table de traitement puis effectuent les vérifications nécessaires.
Comment adapte-t-on la dose ?
Au cours de la consultation médicale, l’oncologue radiothérapeute détermine la dose que le patient va recevoir en fonction de l’indication, d’une dose éventuelle antérieurement reçue dans le même territoire et de son état général. Selon ces critères, l’oncologue radiothérapeute détermine la dose à adapter, c’est à-dire la dose optimale permettant le contrôle de la tumeur en limitant au maximum les effets secondaires.
Pour chaque patient, après repérage de la tumeur par scanner, la
répartition de la dose est calculée par un dosimétriste, vérifiée par un
radiophysicien et enfin par le médecin. Un contrôle supplémentaire de la dose reçue est alors effectué par l’installation d’un dosimètre posé sur le patient au cours d’une séance de traitement au moins une fois par semaine (dosimétrie in vivo).
La dose est donc personnalisée et adaptée à chaque patient et la
répartition calculée selon la morphologie de chaque patient, avec
des contrôles stricts.
Quelles sont les modalités pratiques de la radiothérapie ?
Les séances de radiothérapie ont lieu en général une fois par jour, 5 jours sur 7, pendant 2 à 5 semaines selon l’indication. Les séances n’excèdent pas 10 minutes. Avec le temps d’installation et d’attente dans le service, le patient passe environ 30 minutes par jour dans le service.
Ces séances sont réalisées par des techniciens en radiothérapie, appelés manipulateurs en électroradiologie. À chaque séance, le manipulateur installe le patient sur la table de traitement puis effectue les vérifications nécessaires.
Lors de la radiothérapie proprement dite, le patient est seul dans la salle de traitement, sous surveillance audiovisuelle. Le traitement est indolore. Il est très important que le patient reste totalement immobile pour que le traitement soit d’une qualité optimale.
On n’est pas « radioactif » en sortant de la séance de radiothérapie.
On peut donc rester au contact de nourrissons, de femmes enceintes, de personnes âgées ou de personnes « fragiles », sans aucun danger pour eux.
Si une chimio-radiothérapie est proposée, une chimiothérapie orale ou par perfusion est réalisée dans le même temps que la radiothérapie.
Si le patient n’est pas hospitalisé, il devra se rendre quotidiennement
au centre de radiothérapie (par ses propres moyens s’il le souhaite, en taxi ou dans un véhicule sanitaire, des bons de transport sont effectués pour toutes les séances en amont).
Quels sont les effets secondaires de la chimio-radiothérapie ? Comment les prévenir et comment les traiter ?
Au cours de la radiothérapie, la rencontre avec l’oncologue radiothérapeute en consultation de suivi a lieu une fois par semaine de manière systématique et, en cas de besoin, à la demande : il ne faut donc pas hésiter à le solliciter.
Les effets secondaires de la radiothérapie dépendent de la dose délivrée, de la zone traitée mais également du patient. Certains patients ne seront pas du tout gênés, d’autres présenteront des troubles parfois gênants. Ces effets secondaires sont liés à l’inflammation induite par les rayons.
Les principaux effets secondaires imputables à la radiothérapie sont :
- la fatigue. Elle est autant liée à la radiothérapie qu’aux déplacements pour celle-ci. La fatigue peut être majorée par une
chimiothérapie concomitante. Il est indispensable de se réserver
des périodes de repos au cours de la journée ; - les brûlures d’estomac ou de l’œsophage. Elles peuvent être parfois importantes mais ne sont pas systématiques. Elles surviennent en général après 2 à 3 semaines de traitement. Le médecin prescrit dans ce cas des médicaments antalgiques adaptés. Des médicaments diminuant la sécrétion d’acide gastrique sont recommandés pendant toute la durée de l’irradiation et pendant les 6 mois suivant celle-ci ;
- les nausées et vomissements. Ces effets sont liés à l’action des
rayons sur le plexus cœliaque, carrefour nerveux situé derrière
l’estomac. Ils sont prévenus par des médicaments contre les nausées administrés systématiquement environ 1 heure avant la
séance de radiothérapie ; - le manque d’appétit. Il est recommandé de fractionner les repas,
de manger en petite quantité et plus souvent, d’utiliser des compléments nutritionnels. Demander l’avis de la diététicienne
du service est fortement conseillé ; - la diarrhée. Elle est liée à l’irradiation de l’intestin grêle. Elle est
rare avec les techniques actuelles d’irradiation. Elle est maîtrisée
grâce à des traitements antidiarrhéiques classiques associés à des
mesures diététiques ; - la dysphagie (difficulté à avaler) : elle peut apparaître lors des irradiations préopératoires. Il faut le signaler au médecin. En cas
d’impossibilité complète pour avaler, l’hospitalisation devient nécessaire. Un traitement par anti-inflammatoires permet de
limiter cette symptomatologie.
Il ne faut pas oublier que ces effets secondaires disparaissent dans les semaines qui suivent l’arrêt du traitement.
Des effets secondaires tardifs peuvent cependant apparaître quelques mois à quelques années après la radiothérapie.
En cas de fatigue, d’amaigrissement, les rayons sont-ils supportables ?
Oui, car la dose est déterminée de manière individuelle afin de limiter les effets secondaires. Si le patient est trop fragile ou trop fatigué, le traitement n’est alors pas prescrit par les médecins.
Il faut retenir que l’irradiation au niveau de l’estomac n’entraîne pas par elle-même une fatigue importante.
En cas d’amaigrissement, il est important de prendre les traitements limitant les brûlures ou les nausées ayant un retentissement sur l’alimentation. Des compléments nutritionnels sont prescrits en association avec un suivi nutritionnel assuré par une diététicienne.
Cette prise en charge permet la réalisation du traitement.
4. Les thérapies ciblées
Qu’est-ce qu’une thérapie ciblée – généralités – ?
La chimiothérapie conventionnelle s’attaque à la multiplication des cellules (prolifération par division cellulaire). Si elle est active sur les cancers, c’est parce que les cellules tumorales se multiplient plus vite que les cellules normales, ces dernières sont cependant également touchées par la chimiothérapie (c’est ce qu’on appelle la toxicité).
Les nouveaux médicaments contre le cancer s’attaquent aux cellules tumorales en agissant sur des caractéristiques spécifiques à celles-ci. Ils doivent idéalement bloquer les systèmes de multiplication cellulaire qui existent uniquement dans les cellules tumorales et qui n’existent pas ou peu dans les cellules normales.
Ces nouveaux médicaments sont appelés « thérapies ciblées ».
On en attend une plus grande efficacité et une moindre toxicité par rapport à la chimiothérapie à laquelle ils peuvent d’ailleurs être associés.
À ce jour, trois grands mécanismes presque spécifiques des cellules
tumorales ont été identifiés, jouant un rôle important dans la prolifération tumorale :
- La néovascularisation tumorale : pour se développer, envahir
les organes puis donner des métastases, la tumeur a besoin de
fabriquer des vaisseaux sanguins pour se nourrir, c’est ce que l’on
appelle la néovascularisation ou « angiogenèse* ». Les cellules
tumorales fabriquent des messagers, comme le VEGF (Vascular
Endothelial Growth Factor), qui vont se fixer sur les cellules des
vaisseaux sanguins et induire leur développement au sein de la
tumeur. Il existe désormais plusieurs médicaments capables de
freiner, voire d’empêcher l’angiogenèse tel que le bevacizumab, un anticorps* dirigé contre le VEGF et diminuant la formation des néo vaisseaux (angiogénèse). - Les facteurs de croissance tumoraux : les cellules cancéreuses
portent à leur surface des récepteurs des facteurs de croissance.
Cette interaction entre le récepteur et son facteur de croissance va
entrainer l’activation de signaux dans la cellule tumorale qui à leur tour vont stimuler la croissance de la tumeur. Plusieurs facteurs de croissance ont été identifiés, comme par exemple l’EGF (Epidermal Growth Factor). Plusieurs médicaments sont aujourd’hui capables de bloquer le récepteur à l’EGF et ainsi d’empêcher l’EGF de stimuler la prolifération tumorale tels que le cetuximab et le panitumumab, deux anticorps monoclonaux dirigés contre le récepteur de l’EGF. - L’immunothérapie : elle vise à permettre à l’organisme d’agir contre les tumeurs en stimulant ses propres défenses immunitaires et en levant les mécanismes d’inhibition induits par les cellules tumorales dans certaines formes particulières de tumeurs.
Il existe deux grandes classes de médicaments de thérapie ciblée* :
Les anticorps monoclonaux
Le principe consiste à administrer des anticorps (assimilables à des
missiles intelligents) dirigés spécifiquement contre des récepteurs situés à la surface des cellules cancéreuses ou directement contre des facteurs de croissance (sorte d’hormones favorisant la production de cellules). Le blocage de ces récepteurs ou de ces facteurs de croissance empêche leur activation et par conséquent bloque la transmission des signaux de prolifération en direction des cellules cancéreuses. Les anticorps monoclonaux ont tous en commun d’être administrés par voie intraveineuse le plus souvent avec une chimiothérapie.
Les tyrosines kinase inhibiteurs
Ce sont de petites molécules capables d’inhiber des enzymes ou protéines le plus souvent impliquées dans les voies de signalisation
intracellulaire qui vont du récepteur à leur cible. Ces petites molécules ont l’avantage de pouvoir être prises par voie orale. Elles peuvent inhiber aussi les récepteurs à l’EGF (Endothelial Growth Factor) et l’angiogenèse.
Quelles sont les thérapies ciblées utilisées dans les cancers de l’estomac et du cardia ?
Le trastuzumab
Environ 20% des adénocarcinomes de l’estomac ou du cardia sur expriment HER-2 (récepteur 2 du facteur de croissance épidermique
humain, appelé aussi ErbB2 ou encore Her2neu). Lorsque ce biomarqueur est mis en évidence, un anticorps
monoclonal* bien connu dans la prise en charge des cancers du sein, peut être associé à la chimiothérapie par fluoropyrimidines et sels de
platine dans les situations où les cancers de l’estomac et du cardia sont métastatiques. C’est le trastuzumab, anticorps monoclonal recombinant, conçu pour reconnaître spécifiquement la partie extracellulaire d’(HER2). En se liant à Her2, il bloque la croissance des
cellules tumorales et active certaines cellules du système immunitaire
(les défenses naturelles de l’organisme), qui détruisent alors les cellules
tumorales. Le trastuzumab a démontré son efficacité en association à un schéma de chimiothérapie conventionnelle (5FU et Cisplatine) par rapport à la chimiothérapie seule et cette combinaison est utilisée en routine chez des patients ayant un cancer gastrique métastatique
surexprimant HER2*, en 1ère ligne de traitement.
Le trastuzumab s’administre de façon intraveineuse juste avant la chimiothérapie, toutes les 2 ou 3 semaines selon le protocole de chimiothérapie utilisé en association et ne nécessite pas de venue supplémentaire à l’hôpital de jour.
Les effets secondaires du trastuzumab sont rares. Une réaction allergique a été observée dans moins de 10% des cas. On peut observer la survenue de manifestations d’hypersensibilité (fièvre, frissons, prurit, asthénie, chute tensionnelle) lors de la perfusion mais aussi des douleurs articulaires et musculaires. Une toxicité cardiaque avec notamment une insuffisance cardiaque a été décrite, le plus souvent réversible, dont le mécanisme n’est pas clair. La surveillance cardiaque de tous les patients doit donc être effectuée pendant la durée du traitement avec une surveillance plus étroite encore chez les patients ayant des antécédents de problèmes cardiaques. On retient au minimum une surveillance habituellement par échographie cardiaque de la fraction d’éjection ventriculaire gauche tous les 3 mois après réalisation d’un examen de référence avant le début du traitement. Les autres rares effets indésirables parfois observés sont des douleurs abdominales, une fatigue, des frissons, de la fièvre, des maux de tête, une diarrhée, des nausées, des vomissements, et des éruptions cutanées.
Le trastuzumab déruxtécan
Il s’agit d’un anticorps conjugué composé du trastuzumab fixé à une chimiothérapie (le déruxtécan, inhibiteur de topoisomérase I). Ce composé a la capacité de se fixer sur les cellules tumorales qui
surexpriment HER2 et de diffuser ensuite par contiguïté au niveau des cellules environnantes, y compris au niveau des cellules qui n’expriment pas HER-2, entrainant ainsi une destruction des cellules
cancéreuses. Il a montré son efficacité chez des patients avec une tumeur HER2+ en échec de traitement à base de trastuzumab. Ce
médicament est désormais accessible en France.
Son administration se fait par voie intraveineuse toutes les 3 semaines.
Ses effets indésirables sont essentiellement marqués par un risque de
pneumopathie interstitielle (développée chez 10 % des patients). C’est
pourquoi une surveillance attentive après une imagerie pulmonaire de référence normale sera effectuée par la réalisation d’un scanner thoracique tous les 2 cycles de même qu’une information auprès des patients de signaler toute toux, difficulté à respirer ou fièvre. Ce traitement peut entraîner des nausées et/ou vomissements et un traitement préventif est administré. Comme le trastuzumab, ce médicament peut avoir une toxicité cardiaque en diminuant la fraction d’éjection ventriculaire gauche (FEVG) et une surveillance de celle-ci est à réaliser après un examen de référence.
Le ramucirumab
Le ramucirumab est un anticorps monoclonal dirigé contre le récepteur
2 du VEGF (facteur de croissance de l’endothélium vasculaire). Il a une
action antiangiogénique c’est-à-dire qu’il bloque le développement de vaisseaux impliqués dans la croissance tumorale et a montré son efficacité dans le traitement du cancer gastrique métastatique en deuxième ligne. Le ramucirumab peut être utilisé seul ou en combinaison avec une chimiothérapie de type taxane (le paclitaxel).
Bien que son efficacité soit démontrée par des études cliniques, et qu’il ait reçu une autorisation de mise sur le marché (AMM), le ramucirumab n’est pas remboursé en France car les autorités de santé
ont estimé que l’amélioration du service médical rendu (ASMR) était
insuffisant.
Le zolbetuximab
Le zolbetuximab est un anticorps monoclonal dirigé contre la claudine-18, molécule impliquée dans les jonctions entre les cellules afin d’en assurer leur cohésion. Lors du processus cancéreux, il existe une
désorganisation des cellules avec une surexpression de la claudine-18
qui devient accessible à cet anticorps. En association à une chimiothérapie par fluoropyrimidines et oxaliplatine en 1ère ligne de traitement pour un adénocarcinome gastrique ou du cardia, il a fait la
preuve de son efficacité dans des essais de phase III chez les patients
surexprimant la claudine-18 à 75% ou plus au niveau des cellules tumorales en immunohistochimie ce qui représente environ 35% des
patients. Cette molécule n’est pas encore disponible en dehors d’un
essai clinique. Il n’y a pas eu de surtoxicité rapportée par l’ajout du
zolbetuximab si ce n’est une proportion plus importante de nausées
et vomissements immédiats nécessitant un traitement préventif bien
conduit. Une demande d’autorisation de mise sur le marché (AMM) de
ce médicament est en cours et son accessibilité en France, attendue.
Le bemarituzumab
Le bémarituzumab est un anticorps monoclonal dirigé contre le FGFR 2b (récepteur 2b des facteurs de croissance des fibroblastes) et concerne environ 30% des patients ayant un adénocarcinome de
l’estomac ou du cardia. Une étude de phase II randomisée a mis en
évidence des résultats d’efficacité de l’association de cet anticorps
avec une chimiothérapie par fluoropyrimidines et oxaliplatine en 1ère
ligne métastatique chez les patients surexprimant FGFR 2b (2+ ou
3+) en immunohistochimie dans 10% ou plus des cellules tumorales.
L’effet secondaire particulier de cette thérapie ciblée est une toxicité
au niveau de la cornée (kératite, sécheresse, vision floue) imposant un
suivi ophtalmologique.
Des études cliniques de phase III sont actuellement en cours pour démontrer l’intérêt de ce médicament en association à la chimiothérapie avec ou sans immunothérapie.
Quelle est la place de l’immunothérapie dans les cancers de l’estomac ou du cardia ?
Certains anticorps monoclonaux anti-PD1 (programmed celldeath-1), anti PDL1* (programmed cell death ligand-1) ou anti CTL4 (antigène 4 du lymphocyte T cytotoxique) appelés inhibiteurs des points de contrôle immunitaire ont prouvé leur efficacité dans certains cancers comme le mélanome malin, le cancer du poumon ou le cancer du rein.
En situation métastatique
Le traitement par inhibiteurs de points de contrôle de l’immunité
anti-PD1 comme le nivolumab ou le pembrolizumab s’est imposé en 1ère ligne en association avec la chimiothérapie par fluoropyrimidines et sels de platine dans les cancers gastriques et du cardia métastatiques HER2 négatifs (HER2-). L’éligibilité à l’immunothérapie dépend du niveau d’expression de PDL 1, appréciée par le score CPS (voir « Question 14 ») dont le choix en pratique clinique dépend actuellement de la localisation de la tumeur et de la molécule que l’on compte utiliser. Pour un adénocarcinome gastrique et du cardia métastatique HER2- avec un score CPS ≥5, une chimiothérapie associée à du nivolumab est autorisée et recommandée. Pour un adénocarcinome du cardia Siewert I avec un score CPS ≥ 10, une chimiothérapie associée à du pembrolizumab est possible et remboursée.
Récemment une étude clinique de phase III randomisée a évalué une
association de chimiothérapie par fluorpyrimidines+oxaliplatine avec le pembrolizumab en 1ère ligne chez des patients ayant un adénocarcinome gastrique ou du cardia métastatique HER2- de score CPS ≥ 1. Les résultats positifs de cette étude ont abouti à une AMM Européenne et les autorités françaises ont autorisé le remboursement de cette association pour les tumeurs ayant un score CPS supérieur ou égal à 10.
Pour les adénocarcinomes gastrique ou du cardia métastatiques qui surexpriment HER2 (HER2+), une AMM a été obtenue pour le pembrolizumab en association à une chimiothérapie de type fluoropyrimidine + sels de platine et au trastuzumab chez les patients avec une tumeur surexprimant PD-L1 avec un score CPS≥1.
Pour les cancers ayant une instabilité microsatellitaire (MSI*)
en rapport avec un déficit de la réparation de l’ADN (dMMR), les
indications d’association chimiothérapie+nivolumab ou pembrolizumab sont les mêmes que celles des patients décrits ci-dessus, en 1ère ligne métastatique. Une monothérapie de pembrolizumab est également autorisée et dispose d’une AMM après au moins une ligne de chimiothérapie.
En situation non métastatique
Pour les cancers de la jonction œsogastrique traités par une chimie
radiothérapie suivie d’une chirurgie, il est désormais recommandé
d’administrer une immunothérapie (nivolumab) pendant 1 an s‘il
persiste du tissu tumoral au sein de la pièce opératoire, et ce quel que soit le score CPS sur les cellules tumorales. En effet, ce traitement par immunothérapie permet de réduire le risque de rechute ou de décès. Pour les patients présentant une tumeur dMMR/MSI, plusieurs études de phase II ont démontré l’efficacité d’une monothérapie d’immunothérapie (anti-PD1) ou d’une combinaison d’immunothérapie (anti-PD1+anti-CTLA4) en pré ou péri-opératoire pour des cancers gastriques ou du cardia non métastatiques et opérables avec un taux très élevé de pièce opératoire ne contenant plus de cellules tumorales (réponse complète). Des essais thérapeutiques à venir interrogeront la possibilité de ne plus opérer ces tumeurs en cas de réponse complète confirmée.
Quels sont les effets secondaires de l’immunothérapie ?
L’usage de l’immunothérapie (seule ou en association avec la chimiothérapie) est associé à des effets indésirables propres à
l’immunothérapie, dits immuno-médiés et peuvent toucher tous les organes et tissus. Le plus souvent, ces effets sont légers et réversibles lorsqu’ils sont détectés et traités.
Le plus important est que le patient fasse part à l’équipe qui le suit de tout symptôme nouveau ou inhabituel afin qu’un suivi clinique et/ou des analyses de sang supplémentaires soient réalisés. Il n’y a pas de moment spécifique lié à l’apparition des effets secondaires et ce peut être juste après une perfusion comme au bout de plusieurs mois de traitement.
Les symptômes cutanés (rougeurs et démangeaisons) sont les plus fréquents mais il peut aussi y avoir des symptômes gastro-intestinaux (diarrhée, douleurs abdominales), des symptômes pulmonaires (essoufflement, toux) ou des troubles endocriniens (fatigue, perte de poids, nausées, soif, miction excessive).
D’autres symptômes moins fréquents peuvent aussi apparaître : confusion, douleurs articulaires, gonflement des articulations, fièvre, douleurs musculaires, perte de la vision. Les symptômes rénaux (insuffisance rénale) ou cardiaques sont rares (<1%). Des symptômes neurologiques sont également décrits chez 4 à 6% des patients et sont plus risqués si le traitement comprend une combinaison d’immunothérapie par anti-CTLA-4 et anti-PD-1 (jusqu’à 12 %). Ils peuvent se manifester de différentes façons (faiblesse musculaire, engourdissement et difficultés respiratoires).
Comment les effets secondaires liés à l’immunothérapie sont-ils pris en charge ?
Les effets secondaires peu sévères ou modérés sont généralement pris en charge de manière symptomatique, sans interrompre temporairement ou définitivement le traitement. Les effets secondaires modérés mais persistants peuvent entraîner l’arrêt temporaire du traitement jusqu’à ce que les symptômes s’améliorent.
Les effets graves ou très graves entraînent le plus souvent un arrêt définitif du traitement avec consultation auprès du spécialiste concerné par l’effet secondaire présenté. Un traitement par des corticoïdes par voie intraveineuse ou par voie orale, ou d’autres médicaments immunosuppresseurs peuvent alors être utilisés. Certaines situations cliniques sont discutées dans une RCP (réunion de concertation pluridisciplinaire) dédiée aux toxicités des immunothérapies afin de décider de la meilleure prise en charge à adopter afin de poursuivre le traitement d’immunothérapie sans risque.
Si le patient a des questions ou des doutes, ou qu’il remarque l’apparition d’un symptôme inquiétant (ou l’aggravation de symptômes existants), il doit en informer dès que possible son médecin ou l’équipe oncologique afin qu’ils puissent les traiter rapidement et lui prescrire le meilleur traitement possible.
5. La recherche
Qu’est-ce-qu’un essai clinique ?
Un essai clinique* est une recherche faite auprès de patients pour évaluer scientifiquement la valeur d’un nouveau médicament ou d’une nouvelle combinaison de médicaments. Il permet :
- aux patients, de bénéficier de nouveaux traitements non encore
disponibles en dehors de ces essais cliniques ; - aux médecins, de développer les traitements de demain.
Voici en quelques mots la stratégie utilisée pour le développement de nouveaux traitements :
- une fois qu’une molécule prometteuse a été identifiée par un
laboratoire de recherche et que les études précliniques ont été
réalisées (expérimentations réalisées en culture cellulaire et chez
l’animal avant l’utilisation de la molécule chez l’homme), les essais thérapeutiques de phase I peuvent commencer. Ils s’adressent aux patients pour lesquels aucun traitement efficace n’est disponible. Le but de ces essais est de déterminer les doses tolérées et les effets secondaires, et non d’apprécier l’efficacité des traitements testés ; - les études de phase II suivent et cherchent à vérifier que le
traitement est actif. Cette phase vise à apprécier les réponses
tumorales et à analyser les effets secondaires ; - les études de phase III constituent l’étape la plus importante.
Quand un traitement actif a été identifié et donne des résultats
prometteurs en phase II, il faut le comparer aux traitements
antérieurs et voir s’il leur est supérieur. Ces études de phase
III demandent un nombre beaucoup plus grand de patients
habituellement plusieurs centaines et font l’objet d’une randomisation, c’est-à-dire d’une sorte de tirage au sort élaboré.
Ni le patient ni le médecin n’ont le choix du traitement, entre
l’ancien et le nouveau. C’est le seul moyen scientifique possible
pour réellement comparer deux traitements et ainsi pouvoir définir d’éventuels nouveaux standards de traitement. Si le médecin propose au patient de participer à un essai clinique,
celui-ci doit accepter sans crainte car les essais thérapeutiques font l’objet d’une réglementation particulière. Ils sont approuvés par un comité d’éthique, déclarés aux autorités françaises et européennes compétentes. Enfin, ils sont soumis à des règles appelées « bonnes pratiques cliniques » (BPC).
Le patient doit alors recevoir une lettre d’information et signer avec son médecin un formulaire de consentement éclairé avant d’entrer dans l’essai clinique retenu. Sa participation est donc totalement volontaire.
Auteurs










